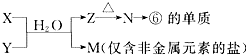题目内容
电解质在工农业生产和各种生命活动中都起着重要作用,下列有关电解质的叙述正确的是( )
| A、强电解质溶液比弱电解质溶液的导电能力强 |
| B、电解质一定是化合物 |
| C、SO3 溶于水形成的溶液能导电,所以SO3 是电解质 |
| D、NaCl固体不导电,所以NaCl不是电解质 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:A.强电解质溶液的导电能力不一定比弱电解质溶液强;
B.电解质:在水溶液中或熔融状态下能够导电的化合物;
C.非电解质:在熔融状态和水溶液中都不能导电的化合物;
D.NaCl固体在水中或熔化状态下能导电.
B.电解质:在水溶液中或熔融状态下能够导电的化合物;
C.非电解质:在熔融状态和水溶液中都不能导电的化合物;
D.NaCl固体在水中或熔化状态下能导电.
解答:
解:A.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故A错误;
B.电解质:在水溶液中或熔融状态下能够导电的化合物,故B正确;
C.SO3 溶于水形成的溶液能导电,但三氧化硫自身不能电离,所以SO3 是非电解质,故C错误;
D.NaCl固体在水中或熔化状态下能导电,是电解质,故D错误;
故选B.
B.电解质:在水溶液中或熔融状态下能够导电的化合物,故B正确;
C.SO3 溶于水形成的溶液能导电,但三氧化硫自身不能电离,所以SO3 是非电解质,故C错误;
D.NaCl固体在水中或熔化状态下能导电,是电解质,故D错误;
故选B.
点评:本题考查电解质、非电解质概念的辨析,强弱电解质溶液导电能力的关系,难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子组一定能大量共存的是( )
| A、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | ||
| B、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| C、含大量Al3+的溶液中:K+、Na+、NO3-、ClO- | ||
D、
|
在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为( )
| 1 |
| 3 |
| A、2.0mol?L-1 |
| B、1.0mol?L-1 |
| C、2.4mol?L-1 |
| D、1.2mol?L-1 |
已知N2O4(g)?2NO2(g)△H>0,现将1mol N2O4充入一恒压密闭容器中,如图示意图正确且能说明反应达到平衡状态的是( )
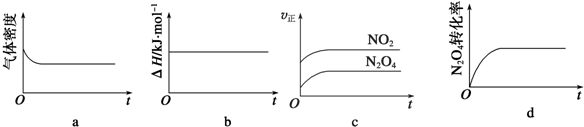

| A、ab | B、bc | C、ac | D、ad |
等体积等物质的量浓度的硫酸,氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为4:5,则甲、乙两烧杯中的反应情况可能分别是( )
| A、甲、乙中都是铝过量 |
| B、甲中铝过量,乙中碱过量 |
| C、甲中酸过量,乙中铝过量 |
| D、甲中酸过量,乙中碱过量 |
阿斯匹林的结构简式为 ,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
 ,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )| A、1摩 | B、2摩 | C、3摩 | D、4摩 |
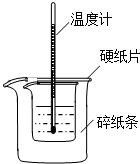 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: