题目内容
在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为( )
| 1 |
| 3 |
| A、2.0mol?L-1 |
| B、1.0mol?L-1 |
| C、2.4mol?L-1 |
| D、1.2mol?L-1 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:氯气的物质的量是0.1mol,因还原性Fe2+>Br-,溶液中有
的Br-被氧化成单质Br2,先后发生2Fe2++Cl2═2Fe3++2Cl-,2Br-+Cl2=Br2+2Cl-,结合电子得失守恒计算.
| 1 |
| 3 |
解答:
解:设FeBr2的物质的量浓度为c,
由电子守恒可知,
×2=c×0.1L×(3-2)+c×0.1L×2×
×(1-0),
解得c=1.2mol/L,
故选D.
由电子守恒可知,
| 2.24L |
| 22.4L/mol |
| 1 |
| 3 |
解得c=1.2mol/L,
故选D.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,学生应注意物质的性质及氧化还原反应中电子守恒来分析,难度不大.

练习册系列答案
相关题目
下列分离或提纯混合物的方法正确的是( )
| A、除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤 |
| B、用乙醇萃取碘水中的碘 |
| C、用溶解过滤蒸发的方法除去固体BaCl2中的BaSO4 |
| D、提纯含有少量硝酸钡杂质的硝酸钾溶液,加入过量硫酸钾溶液,过滤,滤液中补加适量硝酸 |
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g),经10分钟后,反应达到平衡,此时C(SO3)=0.4mol/L,C(SO2)=0.1mol/L,则下列叙述不正确的是( )
| A、SO3的分解率为20% |
| B、平衡时,v(O2)=0.005 mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、加压,容器内固体质量不变 |
如图所示,根据下列实验现象,所得结论正确的是( )
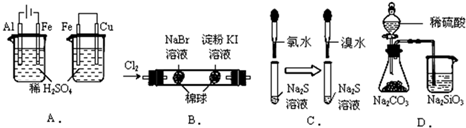

| A、实验现象:左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 实验结论:活动性:Al>Fe>Cu |
| B、实验现象:左边棉花变为橙色,右边棉花变为蓝色 实验结论:氧化性:Cl2>Br2>Ⅰ2 |
| C、实验现象:左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 实验结论:氧化性:Cl2>Br2>S |
| D、实验现象:锥形瓶中有气体产生,烧杯中液体变浑浊 实验结论:非金属性:S>C>Si |
下列有关说法错误的是( )
| A、向溶液中加盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中有SO42- |
| B、向溶液中加稀硝酸酸化的AgNO3溶液产生白色沉淀,证明溶液中有Cl- |
| C、利用丁达尔效应可区分FeCl3溶液和Fe(OH)3胶体 |
| D、用品红溶液可区别二氧化硫和二氧化碳气体 |
下列各项所给的两个量,前者-定大于后者的是( )
①纯水在25℃和80℃的pH
②1moINaHSO4和1mo1Na2SO4在熔化状态下的离子数
③25℃时,等体积且pH都等于3的盐酸和AlCl3的溶液中,已电离的水分子数
④含1mol FeCl3的饱和溶液与水完全反应转化为氢氧化铁胶体后其中胶体粒子的数目与阿伏加德罗常数.
①纯水在25℃和80℃的pH
②1moINaHSO4和1mo1Na2SO4在熔化状态下的离子数
③25℃时,等体积且pH都等于3的盐酸和AlCl3的溶液中,已电离的水分子数
④含1mol FeCl3的饱和溶液与水完全反应转化为氢氧化铁胶体后其中胶体粒子的数目与阿伏加德罗常数.
| A、②④ | B、①③ | C、只有① | D、②③ |
电解质在工农业生产和各种生命活动中都起着重要作用,下列有关电解质的叙述正确的是( )
| A、强电解质溶液比弱电解质溶液的导电能力强 |
| B、电解质一定是化合物 |
| C、SO3 溶于水形成的溶液能导电,所以SO3 是电解质 |
| D、NaCl固体不导电,所以NaCl不是电解质 |