题目内容
2.设NA为阿伏伽德罗常数(1)3.01×1023个NH4+,其质量为9g.
(2)欲配制1L 0.2mol.L-1的盐酸溶液,需标准状况下HCl的体积为4.48L.
(3)现将50mL密度为1.84g/cm3,质量分数为98.0%的浓硫酸,稀释至250mL,则稀释后,溶液的物质的量浓度为3.68mol.L-1.
(4)19克MgCl2中含有离子数目0.6NA.
(5)所含原子数相等的甲烷和氨气(NH3)的质量比为64:85.
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$=cV结合c=$\frac{1000ρω}{M}$以及物质的构成计算.
解答 解:(1)n(NH4+)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,m(NH4+)=0.5mol×18g/mol=9g,故答案为:9;
(2)n(HCl)=1L×0.2mol/L=0.2mol,V(HCl)=0.2mol×22.4L/mol=4.48L,故答案为:4.48 L;
(3)密度为1.84g/cm3,质量分数为98.0%的浓硫酸,物质的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
稀释至250mL,则稀释后,溶液的物质的量浓度为$\frac{18.4mol/L}{5}$=3.68 mol.L-1,故答案为:3.68 mol.L-1;
(4)n(MgCl2)=$\frac{19g}{95g/mol}$=0.2mol,含有离子数目为0.6 NA,故答案为:0.6 NA;
(5)所含原子数相等的甲烷和氨气(NH3)的物质的量之比为4:5,质量比为4×16:5×17=64:85,
故答案为:64:85.
点评 本题考查阿伏加德罗定律及推论,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意物质的量与体积、密度、原子数目的计算公式的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.用NA表示阿斌加德罗常数,下列说法中正确的是( )
| A. | 1mol甲烷中的氢原子被氯原子完全取代,需要2NACl | |
| B. | 1mol•L-1Mg(NO3)溶液中含有NO3-的数目为2NA | |
| C. | 标准状况下.22.4LBr2中所含的分子数为NA | |
| D. | Na2O2与水反应时,每生成0.1 molO2,转移电子的数目为0.2NA |
17.在化学反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1.5mol铜被氧化时( )
| A. | 有4 mol硝酸被还原 | B. | 有2 mol硝酸被还原 | ||
| C. | 转移6 mol电子 | D. | 转移3 mol电子 |
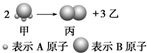 如图所示:已知甲、乙、丙常温下都为气体.2mol甲分子反应生成1mol丙和3mol乙,
如图所示:已知甲、乙、丙常温下都为气体.2mol甲分子反应生成1mol丙和3mol乙, 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: