题目内容
20.氯及其化合物在化学生活中有广泛的应用.ClO2是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,其杀菌、漂白能力均优于Cl2,ClO2易与碱反应.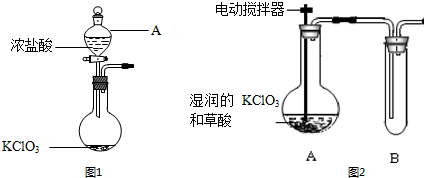
(1)某实验小组采用图1实验装置制取氯气,仪器A的名称为分液漏斗,写出利用该原理制备氯气的化学方程式:KClO3+6HCl(浓)═3Cl2↑+KCl+3H2O.
(2)工业上可以用稍潮湿的KClO3与草酸(H2C2O4)在60℃时反应制取ClO2.某实验小组用图2所示装置制取并收集ClO2,回答下列问题:
①为了保证实验成功,对A装置进行的反应条件控制方式是水浴加热;
②B装置要放置在冰水中,原因是使ClO2 冷凝,便于收集;
③从下图中选出最佳尾气吸收装置B.

(3)亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,可利用ClO2与H2O2在氢氧化钠溶液中反应制得,此反应的氧化产物是O2.(写化学式)
(4)亚氯酸(HClO2)和次氯酸(HClO)都是弱酸,且相同情况下HClO酸性更弱,简述方案验证该结论.实验操作分别取等物质的量浓度的亚氯酸和次氯酸溶液于两个烧杯中,测其pH值,现象次氯酸溶液的pH比亚氯酸溶液的pH大.
分析 (1)由仪器结构特征,可知A为分液漏斗;氯酸钾与浓盐酸反应生成氯气、氯化钾与水;
(2)①反应控制温度为60℃,应采取水浴加热;
②ClO2是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,B装置要放置在冰水中,冷凝便于收集;
③ClO2易与碱反应;
(3)ClO2与H2O2在氢氧化钠溶液中反应制得NaClO2,Cl元素化合价降低,则ClO2为氧化剂,H2O2为还原剂,过氧化氢中氧元素被氧化;
(4)可以测定相同浓度酸的pH或测定相同浓度亚氯酸钠和次氯酸钠溶液的pH.
解答 解:(1)由仪器结构特征,可知A为分液漏斗;氯酸钾与浓盐酸反应生成氯气、氯化钾与水,反应方程式为:KClO3+6HCl(浓)═3Cl2↑+KCl+3H2O,
故答案为:分液漏斗;KClO3+6HCl(浓)═3Cl2↑+KCl+3H2O;
(2)①反应控制温度为60℃,应采取水浴加热,故答案为:水浴加热;
②ClO2是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,B装置要放置在冰水中,使ClO2 冷凝,便于收集,故答案为:使ClO2 冷凝,便于收集;
③ClO2易与碱反应,可以用氢氧化钠溶液吸收,故选:B;
(3)ClO2与H2O2在氢氧化钠溶液中反应制得NaClO2,Cl元素化合价降低,则ClO2为氧化剂,H2O2为还原剂,过氧化氢中氧元素被氧化,氧化产物为,故答案为:O2;
(4)分别取等物质的量浓度的亚氯酸和次氯酸溶液于两个烧杯中,测其pH值,次氯酸溶液的pH比亚氯酸溶液的pH大,
故答案为:分别取等物质的量浓度的亚氯酸和次氯酸溶液于两个烧杯中,测其pH值;次氯酸溶液的pH比亚氯酸溶液的pH大.
点评 本题考查物质制备实验、对操作与装置的分析评价、氧化还原反应、实验方案设计等,是对基础知识的综合应用,注意对题目信息的应用,难度中等.

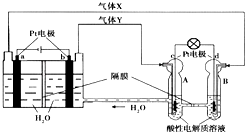 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当有0.1mol电子转移时,a极产生1.12L O2(标况) | |
| B. | b极上发生的电极反应是:2H++2e-═H2↑ | |
| C. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上进行还原反应,B中的H+可以通过隔膜进入A |
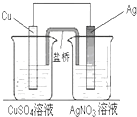 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-═Ag
③盐桥中K+移向CuSO4溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同.
| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
| A. | 烧碱 NaOH | B. | 碱石灰 CaO | C. | 纯碱 Na2CO3 | D. | 小苏打 NaHCO3 |
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| A. | 热稳定性NaHCO3<Na2CO3 | B. | 常温时水中溶解度NaHCO3>Na2CO3: | ||
| C. | 与盐酸反应的速率:NaHCO3>Na2CO3 | D. | 相对分子质量:NaHCO3<Na2CO3 |
Ⅰ.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-825.5kJ/mol
反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5kJ/mol.
Ⅱ.反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
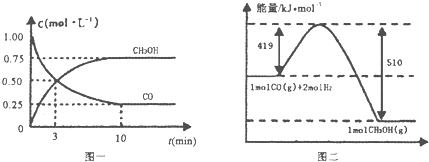
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
A c1=c2B.2Q1=Q3C.2a1=a3D.a1+a2=1E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
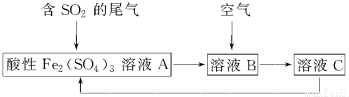
| A. | 溶液B中发生的反应为2SO2+O2═2SO3 | |
| B. | 可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ | |
| C. | 由以上流程可推知氧化性:Fe3+>O2>SO42- | |
| D. | 此工艺的优点之一是物质能循环利用 |
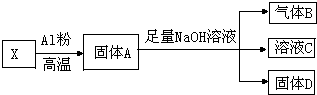 某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)