题目内容
3.某原电池装置如图所示.下列有关叙述中,正确的是( )
| A. | Fe作正极,发生氧化反应 | |
| B. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| C. | 正极反应:2H++2e-=H2↑ | |
| D. | 工作一段时间后,NaCl溶液中c(Na+ )增大 |
分析 图为原电池装置,Fe为负极,发生氧化反应,石墨为正极,发生还原反应,H+得电子被还原生成,原电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题.
解答 解:A.Fe为负极,发生氧化反应,故A错误;
B.工作一段时间后,左边烧杯中生成Fe2+,水解呈酸性,右边烧杯消耗H+,两烧杯溶液pH都发生变化,故B错误;
C.正极发生还原反应,H+得电子被还原生成,电极反应时为2H++2e-=H2↑,故C正确;
D.原电池工作时,阳离子向正极移动,则NaCl溶液中c(Na+ )减小,故D错误;
故选C.
点评 本题考查原电池的工作原理,题目难度不大,注意电极的判断和电极方程式的书写,把握原电池的工作原理,学习中注意相关知识的把握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.化学与社会、生活密切相关,下列有关说法不正确的是( )
| A. | 利用清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐 | |
| C. | 抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等 | |
| D. | 某些蔬菜和水果在人体代谢后,生成碱性物质,所以称为碱性食物 |
14.下列说法正确的是( )
| A. | 相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O; c(NH4+)由大到小的顺序是:①>②>③>④ | |
| B. | 某溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 常温下,若0.1mol/L NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(Y2-)>c(H+)>c (H2Y) |
11.下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) | |
| B. | 物质的量浓度相等的①NH4HCO3溶液、②NH4Cl溶液、③NH4HSO4溶液中,c(NH4+)的大小关系:①>②>③ | |
| C. | 0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
18.下列属于酯化反应的是( )
| A. | CH4+Cl2-→CH3Cl+HCI | |
| B. | CH2═CH2+Br2-→CH2BrCH2Br | |
| C. | nCH2═CH2-→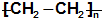 | |
| D. | CH3CH2OH+CH3COOH-→CH3COOCH2CH3+H2O |
15.下列说法不正确的是( )
| A. | 126C和146C互为同位素 | |
| B. | 金刚石和石墨互为同素异形体 | |
| C. | CH3COOCH2CH3和CH3CH2CH2COOH互为同分异构体 | |
| D. | CH4和CH3Cl互为同系物 |
12.下列描述不正确的是( )
| A. | 纯锌与稀硫酸反应比粗锌的反应速率快 | |
| B. | 用稀硫酸与锌制取氢气时,加入少量硫酸铜溶液,可加快反应的速率 | |
| C. | 纯铁比生铁更难发生电化学腐蚀 | |
| D. | 钢铁腐蚀主要是吸氧腐蚀 |
13.用惰性电极电解50mL CuSO4溶液,当两极均生成112mL气体(标准状况下)下列判断不正确的是( )
| A. | 原CuSO4溶液的浓度为0.1mol/L | |
| B. | 反应过程中共转移0.02mol电子 | |
| C. | 向电解后的溶液中加入适量CuO,可恢复到原溶液 | |
| D. | 阳极周围溶液的pH减小 |
