题目内容
6.已知反应KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl作用,则下列说法中正确的是( )| A. | 该反应中转移电子数目为6e | B. | KCl中含有37Cl | ||
| C. | Cl2中只含有37Cl | D. | 生成的氯气式量全为72 |
分析 若用K35ClO3与H37Cl作用,则发生KClO3+6HCl=KCl+3C12↑+3H2O,35Cl得到电子,37Cl失去电子,生成3molC12中有1mol35Cl,以此来解答.
解答 解:A.氯酸钾中Cl元素的化合价由+5价降低为0,该反应中转移电子数为5,故A错误;
B.反应中HCl表现为酸性和还原性,37Cl只存在于KCl,故B正确;
C.35Cl得到电子,37Cl失去电子,Cl2中既有35Cl 又含37C1,故C错误;
D.生成氯气如为35Cl2,则式量为70,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从化合价角度和原子守恒角度分析,题目难度中等.

练习册系列答案
相关题目
8.中药狼巴草的成分之一M具有清炎杀菌作用,M的结构简式如图所示: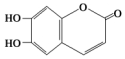 ,下列叙述正确的是( )
,下列叙述正确的是( )
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | M的分子式为C9H6O4 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | 1 molM最多能与4 mol氢氧化钠反应 | |
| D. | M既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
17.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. | 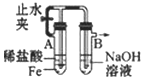 较长时间观察Fe(OH)2白色沉淀 | ||
| C. | 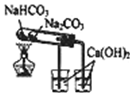 验证NaHCO3和Na2CO3的热稳定性 | D. | 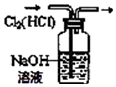 除去Cl2中HCl |
11.下列关于甲烷的叙述错误的是( )
| A. | 含碳质量分数最大的有机物 | |
| B. | 最简单的有机物 | |
| C. | 是天然气的主要成分 | |
| D. | 与氯气在光照条件下能发生取代反应 |
16.NA表示阿伏加罗常数的值,下列说法正确的是( )
| A. | 2.2g CO2中含有的分子数为0.1NA | |
| B. | 0.5mol Na2CO3固体中含有的Na+数为0.5NA | |
| C. | Na2O2与足量水反应时,生成1molO2转移的电子数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的碳原子数为0.2NA |
