题目内容
化学反应N2+3H2=2NH5的能量变化如图所示,该反应化学方程式是( )
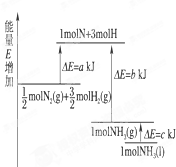

| A、N2(g)+3H2(g)=2NH2(1);△H=2(a-b-c)KJ?mol-1 | ||||
| B、N2(g)+3H2(g)=2NH5(g);△H=2(b-a)KJ?mol-1 | ||||
C、
| ||||
D、
|
考点:热化学方程式
专题:
分析:根据反应热等于反应物旧键断裂吸收的总能量减去生成物新键形成所放出总能量计算反应热,然后根据并热化学方程式的书写方法写出热化学方程式,注意反应物的物质的量和生成物的聚集状态.
解答:
解:由图可以看出,
molN2(g)+
molH2(g)断键吸收的能量为akJ,形成1molNH3(g)的放出的能量为bkJ,所以
N2(g)+
H2(g)=NH3(g)△H=(a-b)kJ/mol,而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
根据盖斯定律可知:
N2(g)+
H2(g)=NH3(l)△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(g)△H=2(a-b-c)kJ/mol,N2(g)+3H2(g)=2NH3(l)△H=2(a-b-c)kJ/mol,
故选A.
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
根据盖斯定律可知:
| 1 |
| 2 |
| 3 |
| 2 |
即:N2(g)+3H2(g)=2NH3(g)△H=2(a-b-c)kJ/mol,N2(g)+3H2(g)=2NH3(l)△H=2(a-b-c)kJ/mol,
故选A.
点评:本题考查热化学方程式的书写,题目难度不大,注意书写热化学方程式的注意事项以及反应热的计算方法.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
下列各物质中含氢原子数最多的是( )
| A、1mol NH4C1 |
| B、1.5mol NH4NO3 |
| C、1.204×1024CO(NH2)2 |
| D、1mol NH3?H2O |
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-Q1kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=-Q2kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g)△H=-Q3kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-Q1kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=-Q2kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g)△H=-Q3kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
| A、Q1>Q2>Q3 |
| B、Q1>Q3>Q2 |
| C、Q3>Q2>Q1 |
| D、Q2>Q1>Q |
 某同学学习了化学反应速率的有关知识后,进行了如下探究,请你参与其中的探究,并分析和解答相关问题.
某同学学习了化学反应速率的有关知识后,进行了如下探究,请你参与其中的探究,并分析和解答相关问题.