题目内容
已知:Fe(s)+ O2(g)===FeO(s) ΔH1=-272 kJ/mol
O2(g)===FeO(s) ΔH1=-272 kJ/mol
2Al(s)+ O2(g)===Al2O3(s) ΔH2=-1 675 kJ/mol
O2(g)===Al2O3(s) ΔH2=-1 675 kJ/mol
则2Al(s)+3FeO(s)===Al2O3(s)+3Fe(s)的ΔH是
A.859 kJ/mol B.-859 kJ/mol
C.-1403 kJ/mol D.-2491 kJ/mol
B
【解析】
试题分析:(1)Fe(s)+ O2(g)=FeO(s)△H=-272kJ?mol-1 ①
O2(g)=FeO(s)△H=-272kJ?mol-1 ①
2Al(s)+ O2(g)=Al2O3(s)△H=-1675kJ?mol-1 ②
O2(g)=Al2O3(s)△H=-1675kJ?mol-1 ②
依据盖斯定律②-①×3得到热化学方程式为:
2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859 kJ?mol-1
考点:考查盖斯定律应用。

练习册系列答案
相关题目
 2C(g) + 2D(g) 测得用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是
2C(g) + 2D(g) 测得用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是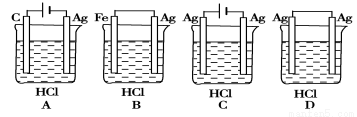
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O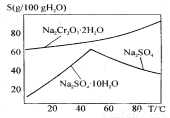
 Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)