题目内容
将铁和氧化铁的混合物15g加入150mL稀硫酸中,在标准状况下放出1.68L气体,同时混合物无剩余.向溶液中滴入硫氰化钾溶液,未见颜色变化.为了中和过量的硫酸,而且使铁完全转化成氢氧化亚铁,共消耗3mol/L的氢氧化钠溶液200mL,则原硫酸溶液的浓度是( )
| A、1.5mol/L |
| B、2mol/L |
| C、2.5mol/L |
| D、3mol/L |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:将铁和氧化铁的混合物加入稀硫酸中,产生气体,向溶液中滴入硫氰化钾溶液,未见颜色变化,说明生成硫酸亚铁,中和过量的硫酸,而且使铁完全转化成氢氧化亚铁,产生溶液中溶质为Na2SO4,根据硫酸根守恒可知n(H2SO4)=n(Na2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),据此计算n(H2SO4),再根据c=
计算.
| n |
| V |
解答:
解:将铁和氧化铁的混合物加入稀硫酸中,产生气体,向溶液中滴入硫氰化钾溶液,未见颜色变化,说明生成硫酸亚铁,中和过量的硫酸,而且使铁完全转化成氢氧化亚铁,产生溶液中溶质为Na2SO4,根据硫酸根守恒可知n(H2SO4)=n(Na2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),
故n(H2SO4)=
n(NaOH)=
×0.2L×3mol/L=0.3mol,故c(H2SO4)=
=2mol/L,
故选B.
故n(H2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
| 0.3mol |
| 0.15L |
故选B.
点评:本题考查混合物计算,难度中等,明确反应过程是解题关键,侧重考查学生分析思维能力,注意利用守恒法进行解答.

练习册系列答案
相关题目
下列各组物质不属于同分异构体的是( )
| A、2,2-二甲基丙醇和2-甲基丁醇 |
| B、邻氯甲苯和对氯甲苯 |
| C、2-甲基丁烷和戊烷 |
| D、乙醇和丙醇 |
往c(H+)相等的一元酸HA和HB的溶液中分别加入适量的锌粉,充分反应后,当收集到的H2气体相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是( )
| A、消耗锌的质量m(HA)>m(HB) |
| B、HA一定是强酸 |
| C、消耗酸的物质的量n(HA)=n(HB) |
| D、生成H2的平均速率V(HA)<V(HB) |
将偏铝酸钠溶液和盐酸等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原偏铝酸钠溶液和盐酸的物质的量浓度之比可能是( )
| A、1:3 | B、2:1 |
| C、1:4 | D、2:5 |
下列说法正确的是( )
| A、增加水的量或升高温度,可以加快镁跟水的反应速率 |
| B、增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率 |
| C、在反应2H++S2O32-=S↓+SO2+H2O中,增大压强,可以加快硫析出的速率 |
| D、煅烧硫铁矿时,把硫铁矿粉碎或通入纯O2可加快反应的速率 |
下列关于命名的说法中错误的是( )
| A、所有烃类的命名都应选择含碳原子最多的链作主链,即“最多”原则 |
| B、二甲苯可以以邻、间、对这种习惯方法进行命名 |
| C、二甲苯也可以用系统方法进行命名 |
| D、化学式是C8H10的苯的同系物有4种同分异构体 |
下列实验操作正确的是( )
| A、用托盘天平称量4.00g氢氧化钠固体 |
| B、用10mL量筒量取8.5mL蒸馏水 |
| C、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| D、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
下列有机物的命名正确的是( )
| A、Br-CH2-CH2-Br二溴乙烷: |
B、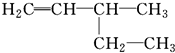 3-乙基-1-丁烯: 3-乙基-1-丁烯: |
C、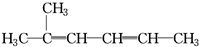 2-甲基-2,4-己二烯: 2-甲基-2,4-己二烯: |
D、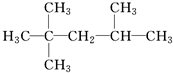 2,2,3-三甲基戊烷: 2,2,3-三甲基戊烷: |
