��Ŀ����
2����ѧʵ��װ�õĿ�ѧ�����ʵ���Ƿ�ȡ��Ԥ��Ч���Ĺؼ�����ش������й�ʵ��װ�õ�������⣺��ͼAΪ���˽̰桱�̲��Ʊ�����������ʵ��װ�ã���ͬѧ��ΪͼBװ�ý���������ӦЧ����A Ҫ�ã����������DZ����������������ٷ�Ӧ����ʧ����ͬѧ������������ΪͼCװ�ý���������ӦЧ�����ã����������Ǽ��������������ܼ�ʱ�������Ӧ���ɵ�ˮ���������������ɣ�

��ijʵ��С����̽��̼��Ũ���ᷴӦ���������ͬѧ�����ͼ1װ�ã���Ϊ���к���ɫ���������˵��̼��Ũ���ᷢ���˷�Ӧ������֪��C+4HNO3 ��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$ 4NO2��+CO2��+2H2O��
��1����ͬѧ��ʵ��Ӧ����ͨ����н��У��ŷ��ϻ�ѧʵ�鰲ȫ�Ե�Ҫ��
��2����ͬѧ��Ϊ����ɫ���岻һ����̼��Ũ���ᷢ����Ӧ���ã���������Ϊ��ͬѧ��
���Ǵ���ģ�����������4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+O2��+2H2O ���û�ѧ����ʽ��ʾ����Ϊ����ͬѧ����������ϵ�֪��0��ʱ����������ΪҺ�塱���Ӷ��Ľ���ʵ��װ����ͼ2��ʾ��
��3�������´��ڣ�2NO2?N2O4����ƽ���ƶ�ԭ������Bװ�õ����ý����¶�N2O4Һ����ƽ�����ƣ���ȥ��������е�NO2�������ֱ�������
��4��Cװ���г��ֵ�������C����Һ����ǣ��������ɫ�������������C����Һ�л�����������Ԫ�أ�ֻ��NO3-��ʽ���ڣ�д�����ɸ����ӵ����ӷ���ʽC����Һ����ǣ��������ɫ��������
���� I��ͼBװ�ý���������ӦЧ����AҪ�ã��������ܵ������йأ�ͼCװ�ý���������ӦЧ�����ã���������������ʹƽ�������ƶ��йأ�
��1��̼��Ũ���ᷴӦ���ɶ�����̼������������ˮ�����������ж���
��2����Ũ����ȶ��������ֽ⣬Ϊ��ֹ���ţ�Ӧ�÷�ֹŨ����ֽ⣻
��3���¶ȵͣ�ƽ�������������������ķ����ƶ���
��4��������̼�ܺ�����������Һ��Ӧ���������Ե�̼�ᱵ������������������ˮ��Ӧ�������ᣬ���������������������кͷ�Ӧ��
��� �⣺��ͼBװ�ý���������ӦЧ����AҪ�ã�����B�������ܱ����������������ٷ�Ӧ����ʧ��ͼCװ�ý���������ӦЧ�����ã�����װ��C�м��������������ܼ�ʱ�������Ӧ���ɵ�ˮ���������������ɣ�
�ʴ�Ϊ�������������������ٷ�Ӧ����ʧ�����������������ܼ�ʱ�������Ӧ���ɵ�ˮ���������������ɣ�
��1�����������ж������ͬѧ��ʵ��Ӧ����ͨ����н��У��ŷ��ϻ�ѧʵ�鰲ȫ�Ե�Ҫ��
�ʴ�Ϊ��ͨ�����
��2��Ũ����ȶ��������ֽ����ɶ���������Ũ�����̼�ڼ��������·�ӦҲ���ɶ������������Զ�ʵ����ɸ��ţ���Ӧ����ʽΪ4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+O2��+2H2O��Ҫ�����Ũ�����̼��Ӧ���ܸ����Ƿ����ɶ��������жϣ�
�ʴ�Ϊ��4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+O2��+2H2O��
��3�����������Ϣ֪��0��ʱ����������ΪҺ�壬�����¶�Խ�ͣ���������Խ�����������������ƶ�������Ҫʹ�ñ�ˮ�������ȴ�����������壬�Ӷ�����������еĶ���������ȥ��
�ʴ�Ϊ�������¶�N2O4Һ����ƽ�����ƣ���ȥ��������е�NO2��
��4������̼�ܺ�����������Һ��Ӧ���������Ե�̼�ᱵ�����Կ����������ǣ�C����Һ����ǣ�����������������ˮ��Ӧ�������ᣬ���������������������кͷ�Ӧ��������Һ�ʳ�����������ӣ���Ӧ����ʽΪ4NO2+O2+2Ba��OH��2=2Ba��NO3��2+2H2O�����ӷ�ӦΪ4NO2+O2+4OH-=4NO3-+2H2O��
�ʴ�Ϊ��C����Һ����ǣ��������ɫ��������4NO2+O2+4OH-=4NO3-+2H2O��
���� ���⿼������ʵ�鷽������ƣ�Ϊ��Ƶ���㣬����ͼ��װ�õ����á���Ӧԭ����ʵ�鼼��Ϊ���Ĺؼ������ط�����ʵ���������ۺϿ��飬��Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | �ױ������ϵ�һ����ԭ�ӱ���3��̼ԭ�ӵ����ȡ�������ò��ﹲ��5�� | |
| B�� | �ƵĽṹ��ʽ��ͼ ���������ᷴӦ��������5��һ����ȡ���� ���������ᷴӦ��������5��һ����ȡ���� | |
| C�� | �� ��Ϊͬ���칹��ķ����廯������6�� ��Ϊͬ���칹��ķ����廯������6�� | |
| D�� | ij���������������к���5��̼ԭ�ӵģ���һ��ȡ���ﹲ��8�� |
 ����һ��ȡ������4�֣���ױ��������ӳɺ�����һ��ȡ�����У�������
����һ��ȡ������4�֣���ױ��������ӳɺ�����һ��ȡ�����У�������| A�� | 4�� | B�� | 5�� | C�� | 3�� | D�� | 6�� |
 �ܱ������з������·�Ӧ��A��g��+3B��g��?2C��g����H��0��������������-ʱ��ͼ�ش��������⣮
�ܱ������з������·�Ӧ��A��g��+3B��g��?2C��g����H��0��������������-ʱ��ͼ�ش��������⣮ 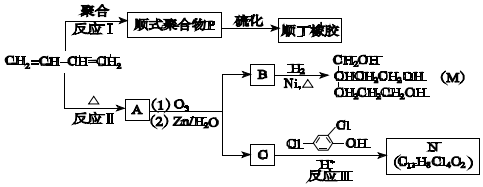
 +
+ $\stackrel{��}{��}$
$\stackrel{��}{��}$
 ��
��


 ��
��

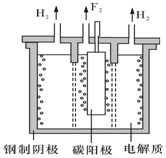 ������Ȼ���й㷺�ֲ���Ԫ��֮һ�����ڷ������⻯ѧ���ʣ���������±���ڵ��ʼ���������Ʊ��������ϴ��ڽ����ԵIJ��죮
������Ȼ���й㷺�ֲ���Ԫ��֮һ�����ڷ������⻯ѧ���ʣ���������±���ڵ��ʼ���������Ʊ��������ϴ��ڽ����ԵIJ��죮