题目内容
17.化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳.而氢气和氮气都被认为是无碳无污染的清洁能源.I.“氢能”将是未来最理想的新能源.
(1)某些合金可川于储存氢,金属储氢的原理可表示为:M+xH2=MH2x△H<0 (M表示某种合金)
图甲表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系.

则下列说法中,正确的是cd.
a.T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M做还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气.其中C(g)+H2O(g)=CO(g)+H2(g),在850℃时平衡常数K=1.若向1L的恒容密闭真空容器中同时加入xmolC和6.OmolH2O.
①850℃时反应达到平衡,x应满足的条件是x>2.
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是b.
a.选用更高效的催化剂 b.升高温度 c.及时分离出氢气 d.增加氢气的浓度
II.CO2是合成尿素的原料
现在以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置乙所示),其中负极通入H2,正极通入O2和CO2的混合气体.乙装置中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL.
(1)工作过程中,乙装置中d电极的电极反应式是O2+4e-+CO2=CO32-,丙装置中电极a为阳极(填电极名称).
(2)若在a极产生112mL(标准状况)气体,25℃时丙装置中所得溶液pH=13(忽略电解前后溶液体积变化)
III.氨是制备尿素的原料,NH3、N2O4等在工农业生产,航天航空等领域有广泛应用.
(1)氨在氧气中燃烧,生成水和一种空气组成成分的单质.已知:N2(g)+3H2(g)?2MH3(g)△H=-92.4kJ/mol及H2的燃烧热为286kJ/mol.试写出氨在氧气中燃烧生成液态水的热化学方程式:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2KJ/mol.
(2)氨气溶于水得到氨水,在25℃下,将a mol•L-1的氨水和b mol•L-1的硫酸以3:2的体积比混合,反应后溶液呈中性.用含a和b的代数式表示出NH3H2O的7电离平衡常数$\frac{4b}{3a-4b}$×10-7.
分析 Ⅰ.(1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,平衡常数是温度的函数,温度不变平衡常数不变,结合表达式分析求解;
(2)①设转化的水为amol,根据平衡常数进行计算;
②化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,结合影响化学反应速率的因素和影响化学平衡的影响因素,以此进行判断,得出正确结论;
Ⅱ.以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图乙所示),其中负极通入H2,正极通入O2和CO2的混合气体,
图丙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,说明溶液中氢离子得到电子发生还原反应,则b电极为电解池阴极,a为电解池阳极,和b电极相连的电极c电极为负极,与a电极相连的d电极为原电池正极,A端通入氢气,B端通入O2和CO2的混合气体,
(1)乙装置中d电极为阳极,电极上的电极反应式是氧气得到电子在熔融盐中和二氧化碳反应生成碳酸根离子;
(2)依据电极反应和电子守恒计算,a极为电解池阳极,产生112mL(标准状况)气体为氢气物质的量=$\frac{0.112L}{22.4L/mol}$=0.005mol,电极反应为:2H++2e-=H2↑,电子转移0.01mol,消耗氢离子物质的量0.01mol,溶液中生成氢氧根离子物质的量为0.01mol,计算氢氧根离子浓度得到溶液pH;
Ⅲ.(1)依据热化学方程式和盖斯定律计算得到,氨气在氧气中燃烧生成液态水的热化学方程式;
(2)根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),现已知c(H+)=c(OH-),所以c(NH4+)=2c(SO42-);Kb(NH3•H2O)=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,c(OH-)=10-7mol•L-1,c(NH4+)=$\frac{4b}{5}$mol•L-1,c(NH3•H2O)=($\frac{3a}{5}$-$\frac{4b}{5}$)mol•L-1,据此分析.
解答 解:Ⅰ.(1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,所以T2→T1,是降温,所以T2>T1,
a.T1<T2,故a错误;
b.M为固体,增大M的量,浓度不变,上述平衡不移动,故b错误;
c.增大氢气压强,反应速率加快,氢气的吸收速率加快,故c正确;
d.金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 平衡可以正向或逆向进行,反应可实现多次储存和释放氢气,金属储氢过程中M做还原剂,价态升高,故d正确;
故答案为:cd;
(2)①C(s)+H2O(g)?CO(g)+H2(g),
开始(mol):6 0 0
转化(mol):a a a
平衡(mol):6-a a a
K=$\frac{a×a}{6-a}$=1,a=2,故x应满足的条件是:x>2,
故答案为:x>2;
②C(g)+H2O(g)=CO(g)+H2(g),改变下列条件能使反应速率增大,且平衡向正向移动的,
a.选用更高效的催化剂增大反应速率,平衡不变,故a错误;
b.反应为吸热反应,升高温度,反应速率增大,平衡正向进行,故b正确;
c.及时分离出氢气平衡正向进行,但反应速率减小,故c错误;
d.增加氢气的浓度平衡逆向进行,反应速率增大,故d错误;
故答案为:b;
Ⅱ.以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图乙所示),其中负极通入H2,正极通入O2和CO2的混合气体,
图丙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,说明溶液中氢离子得到电子发生还原反应,则b电极为电解池阴极,a为电解池阳极,和b电极相连的电极c电极为负极,与a电极相连的d电极为原电池负极,A端通入氢气,B端通入O2和CO2的混合气体,
(1)乙装置中d电极为正极,电极上的电极反应式是氧气得到电子在熔融盐中和二氧化碳反应生成碳酸根离子,电极反应为:O2+4e-+CO2=CO32-,丙装置中电极a为阳极,b为阴极.
故答案为:O2+4e-+CO2=CO32-,阳;
(2)依据电极反应和电子守恒计算,a极为电解池阳极,产生112mL(标准状况)气体为氢气物质的量=$\frac{0.112L}{22.4L/mol}$=0.005mol,电极反应2H++2e-=H2↑,消耗氢离子物质的量为0.01mol,溶液中生成氢氧根离子物质的量为0.01mol,溶液中氢氧根离子浓度c(OH-)=$\frac{0.01mol}{0.1L}$=0.1mol/L,溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,溶液PH=13,
故答案为:13;
Ⅲ.(1)已知:N2(g)+3H2(g)?2MH3(g)△H=-92.4kJ/mol及H2的燃烧热为286kJ/mol.
①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
②2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1,
阴极盖斯定律计算②×3-①×2写出氨气在氧气中燃烧生成液态水的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2KJ/mol,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2KJ/mol;
(2)根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),现已知c(H+)=c(OH-),所以c(NH4+)=2c(SO42-);Kb(NH3•H2O)=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,c(OH-)=10-7mol•L-1,c(NH4+)=$\frac{4b}{5}$mol•L-1,c(NH3•H2O)=($\frac{3a}{5}$-$\frac{4b}{5}$)mol•L-1,;Kb(NH3•H2O)=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$$\frac{\frac{4b}{5}×1{0}^{-7}}{\frac{3a}{5}-\frac{4b}{5}}$=$\frac{4b}{3a-4b}$×10-7,
故答案为:$\frac{4b}{3a-4b}$×10-7.
点评 本题考查了图象的理解应用,主要是化学反应速率、化学平衡影响因素、平衡标志、原电池和电解池原理的分析应用,掌握基础是解题关键,题目难度中等.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案 氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )| A. | 甲胺在水中的电离方程式为:CH3NH2•H2O═CH3NH3++OH- | |
| B. | A、B、C三点溶液中,水电离出来的c(H+):B>C>A | |
| C. | C点所在溶液中$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{H}_{3}^{+})}$=2.5×10-5 | |
| D. | B点溶液中存在c(CH3NH2•H2O)>c(CH3NH3+)>c(H+)>c(OH-) |
 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )| A. | 有机电解液可以是乙醇等无水有机物 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 电池正极反应式是O2+4e-=2O2- | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
| A. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| B. | 将NH4HCO3、AlCl3、FeCl2、KAl(SO4)2的溶液分别加热蒸干、灼烧,均不能得到原物质 | |
| C. | 可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
| A. | 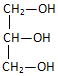 | B. |  | C. | CCl2F2 | D. | H2N-CH2-COOH |
【査阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等.
【实验探究】某化学小组选用图1所示部分装置进行实验(部分夹持装置略)

(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分.
①所选用装置的正确连接顺序为ACBD(填装置的字母序号).
②A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含 FeO 或 Fe3O4:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4.
(2)探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验.
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是分解产物中有SO2,没有SO3.
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式2(NH4)2Fe(SO4)2$\frac{\underline{\;500°C\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O↑.
(3)已知BaSO3、BaSO4均难溶于水,化学小组利用上述实验分离出的SO2气体,进行与可溶性钡盐溶液反应的探究实验(图2).
| 序号 | 步骤 | 现象 |
| I | 向图2装置内充SO2气体 | G中:有气泡冒出,产生白色沉淀;H中:有气泡冒出,产生白色沉淀;液面上方先略显红棕色,后逐渐消失 |
| Ⅱ | 从G、H中过滤出白色沉淀,分别加入稀盐酸中 | G、H中的白色沉淀均不溶解 |
②关于G中有白色沉淀产生的原因,你认为可能是由于装置中的氧气参加了反应.
③写出H中发生反应的离子方程式3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.

