题目内容
18. 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀.若用如图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀.已知两极材料分别为石墨和铁:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀.若用如图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀.已知两极材料分别为石墨和铁:(1)a极材料为Fe,电极反应式为Fe-2e-=Fe2+.
(2)电解液d可以是C,则白色沉淀在电极上生成;电解液d也可以是B,则白色沉淀在两极间的溶液中生成.
A.纯水 B.NaCl溶液
C.NaOH溶液 D.KNO3溶液
(3)液体c为苯,其作用是隔绝空气,防止产物被氧化,在加入苯之前,对d溶液进行加热处理的目的是赶尽溶液中的氧气.
(4)为了在短时间内看到白色沉淀,可以采取的措施是BC.
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为白色沉淀迅速变为灰绿色,最后变为红褐色.
分析 (1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;加热溶液可以排除溶液中溶解的氧气;
(4)短时间内看到白色沉淀,增大反应的速率即可;
(5)反接电源时,电解的是H2O,生成的O2会将Fe(OH)2氧化.
解答 解:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,发生的电极反应为Fe-2e-=Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,若白色沉淀在电极上生成,则电解液d是氢氧化钠,若白色沉淀在两极之间的溶液中生成,则电解液d是氯化钠溶液,但是若电解液为KNO3溶液,则b极会出现白色沉淀,故答案为:C;B;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;加热溶液可以排除溶液中溶解的氧气;
故答案为:隔绝空气,防止产物被氧化;赶尽溶液中的氧气;
(4)短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,
故答案为:BC;
(5)反接电源时,电解方程式是2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:白色沉淀迅速变为灰绿色,最后变为红褐色.
点评 本题考查氢氧化亚铁的制备和电解原理,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化,题目难度不大.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案| A. | NO3- | B. | Ba2+ | C. | OH- | D. | Cu2+ |
| A. | 气体的摩尔体积为22.4 L•mol-12 | |
| B. | 1 mol H2的质量是2 g,它所占的体积是22.4 L | |
| C. | 在标准状况下,1 mol任何气体所占的体积都为22.4 L•mol-1 | |
| D. | 在标准状况下,1 mol任何气体所占的体积都约为22.4 L |
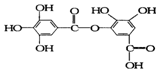
| A. | 它能与纯碱溶液反应 | |
| B. | 它可以水解,水解生成的有机产物有二种 | |
| C. | 1 mol该有机物最多能和8 mol NaOH反应 | |
| D. | 该有机物能发生取代反应 |
| A. | 回收废弃塑料制成燃油来替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| B. | 火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的“硝”是指硝酸 | |
| C. | 高压钠灯发出的黄光射程远、透雾能力强,常用作路灯 | |
| D. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 |




 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: