题目内容
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c (C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
D
解析试题分析:A.根据溶液呈电中性原则,可得c(K+)+c(H+) = c(HC2O4-)+c(OH-)+2c(C2O42-),错误;B.根据物料守恒可得c(HC2O4-)+c (C2O42-) + c(H2C2O4)=" 0.1" mol/L,错误;C. 草酸氢钾溶液呈酸性,说明HC2O4-的电离作用大于其水解作用,所以c(C2O42-) >c(H2C2O4),错误;D.根据物料守恒可得c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-),正确。
考点:考查盐的水解、电离、溶液中离子浓度的大小比较的知识。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为 ;计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为 ;计算该条件下的平衡常数(写出计算过程)。
(2)恒温恒容,能说明反应 2NO(g)  N2(g)+O2(g) 达到平衡的是 (填代号)。
N2(g)+O2(g) 达到平衡的是 (填代号)。
| A.NO、N2、O2的浓度之比为2∶1∶1 |
| B.N2的浓度不再发生变化 |
| C.单位时间内消耗2 mol NO,同时消耗1 mol N2 |
| D.容器内气体密度不再发生变化 |
①已知:N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
H2(g)+1/2O2(g) = H2O(l) △H = —285.8kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为 。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图是反应:2NO(g) + 2CO(g)
 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在下图中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在下图中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件。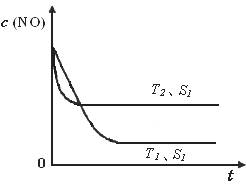
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤②中加热所用仪器的名称是___________________;
(2)步骤③中洗涤沉淀的操作是___________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表: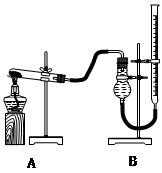
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2 g | 无其他物质 | |
| ⑤ | 1.2 g | CuO 0.5 g | |
| ⑥ | 1.2 g | MnO2 0.5 g | |
(3)上述实验中的“待测数”据指_____________;
(4)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
(5)若要读取实验⑤中干燥管内收集的气体体积,应注意 ____________________
____________________________________________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,
b.CuO的化学性质有没有改变
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO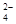 )= c(NH4+) )= c(NH4+) |
| B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大 |
常温下,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,已知相同条件下氨水的电离程度大于NH4+的水解程度,则下列有关推论不正确的是
| A.若混合后溶液pH=7,则c(NH4+)=c(Cl-) |
| B.若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.若a=2b,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b |
一定温度时,向饱和的BaSO4溶液中加水,下列叙述正确的是
| A.BaSO4溶解度增大,Ksp不变 | B.BaSO4溶解度、Ksp均增大 |
| C.BaSO4溶解度不变,Ksp增大 | D.BaSO4溶解度、Ksp均不变 |
25℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
| A.向水中加入氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
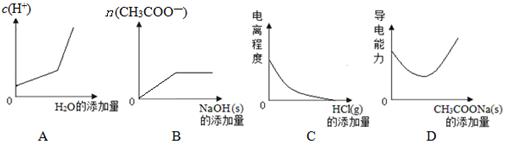
下列物质的水溶液中,呈碱性的是
| A.Na2CO3 | B.Na2SO4 | C.NH4Cl | D.KAl (SO4) 2 |