题目内容
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO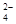 )= c(NH4+) )= c(NH4+) |
| B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大 |
C
解析试题分析:A选项氨水属于弱电解质,不能完全电离,而硫酸属于强电解质,能完全电离,因此A选项是错误的。B选项醋酸属于弱电解质。因此稀释至原来体积的10倍之后,PH应该小于4.D选项硫酸铵是属于强酸弱碱盐,显酸性,因此在氨水中加入硫酸铵,溶液的酸性会增强,因此,氢离子浓度会增大,从而氢氧根离子浓度会减小,因此D选项是错误的。
考点:考查弱电解质电离的相关知识点

练习册系列答案
相关题目
某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
| 实验编号 | KClO3(g) | 氧化物 | 产生气体(mL)(已折算为标况) | 耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | — | — | — | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为 。
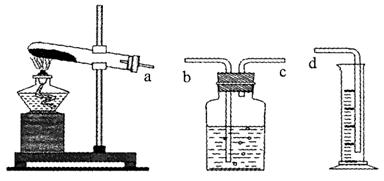
(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2的质量,实验的操作顺序是:溶解→ 。
(3)写出实验室中通过编号2制取氧气的化学方程式:
(4)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 (填物质的化学式)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是 (填化学式),可用 试纸检验该气体,上述异常现象产生的原因是 。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。

下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 块状 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 块状 | 1.0 | 50 | 20 | 35 | 125 |
(1)实验1和3表明, 对反应速率有影响,能表明这种影响因素的实验还有 (填实验序号)。
(2)本实验中影响反应速率的其他因素还有 ,其实验序号是 。该实验说明 ,则反应速率越快;
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
。
25C时,用浓度为0.1000 mol/L的NaOH溶液滴定20. 00 mL 0 .1000 mol·L-1的
CH3COOH.。滴定曲线如图所示。下列分析错误的是
| A.C点的溶液:c(CH3COO一)+c(CH.3COOH)>c(Na+) |
| B.B点的溶液c (CH3COO一)>c(Na+)>c(H+)> c(OH-) |
| C.A点的纵坐标值为l |
| D.D点溶液2c(CH3COOH)十c(H+) =c(OH—)—c(CH3COO—) |
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c (C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
已知25 ℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到KI溶液中,AgCl转化为AgI,因为AgCl溶解度大于AgI |
已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
| A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-) |
| B.c(HSO3-) + c(SO32-) = 0.1mol·L-1 |
| C.c(SO32-) < c(H2SO3) |
| D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-) |
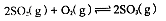 ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: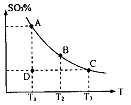
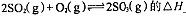 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。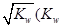 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。