题目内容
一定温度时,向饱和的BaSO4溶液中加水,下列叙述正确的是
| A.BaSO4溶解度增大,Ksp不变 | B.BaSO4溶解度、Ksp均增大 |
| C.BaSO4溶解度不变,Ksp增大 | D.BaSO4溶解度、Ksp均不变 |
D
解析试题分析:一定温度时,向饱和的BaSO4溶液中加水BaSO4溶解度不变,Ksp也不变,因此选项是D。
考点:考查难溶性物质的饱和溶液中加水的过程中的物质的溶解度、溶度积常数的变化关系的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。

25C时,用浓度为0.1000 mol/L的NaOH溶液滴定20. 00 mL 0 .1000 mol·L-1的
CH3COOH.。滴定曲线如图所示。下列分析错误的是
| A.C点的溶液:c(CH3COO一)+c(CH.3COOH)>c(Na+) |
| B.B点的溶液c (CH3COO一)>c(Na+)>c(H+)> c(OH-) |
| C.A点的纵坐标值为l |
| D.D点溶液2c(CH3COOH)十c(H+) =c(OH—)—c(CH3COO—) |
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c (C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
下列有关问题与盐的水解无关的是( )
| A.NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂 |
| B.用NaHCO3与Al2(SO4)3两种溶液可制成泡沫灭火剂 |
| C.常温下测得NaHSO3溶液的pH小于7 |
| D.实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
已知25 ℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到KI溶液中,AgCl转化为AgI,因为AgCl溶解度大于AgI |
25℃时,水中存在电离平衡:

 。下列叙述正确的是
。下列叙述正确的是
A.将水加热, 增大, 增大, 不变 不变 |
B.向水中加入少量NaHSO4固体,c(H+)增大, 不变 不变 |
C.向水中加入少量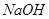 固体,平衡逆向移动, 固体,平衡逆向移动, 降低 降低 |
D.向水中加入少量 固体,平衡正向移动, 固体,平衡正向移动, 增大 增大 |
下列说法正确的是
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
| C.常温下,向10mL PH=3的醋酸溶液中加水稀释后,溶液中C(CH3COO--)/C(CH3COOH) C(OH--)的值减小 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH)/c(NH3·H2O)的值增大 |