题目内容
已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡,
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,求水的转化率?平衡常数K值?
(2)830K时,若起始时:c(CO)═2mol/L,c(H2O)=6mol/L,则水蒸气的转化率是多少?
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,求水的转化率?平衡常数K值?
(2)830K时,若起始时:c(CO)═2mol/L,c(H2O)=6mol/L,则水蒸气的转化率是多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
水蒸气转化率=
×100%;
(2)温度不变,化学平衡常数不变,根据化学平衡常数求出反应掉的水蒸气的物质的量浓度,再根据转化率公式计算水蒸气的转化率.
水蒸气转化率=
| 消耗量 |
| 起始量 |
(2)温度不变,化学平衡常数不变,根据化学平衡常数求出反应掉的水蒸气的物质的量浓度,再根据转化率公式计算水蒸气的转化率.
解答:
解:(1)平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
=1,
水蒸气的转化率=
=40%;
答:水的转化率为40%;平衡常数为1;
(2)设反应的水蒸气的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 6-x x x
故
=1,解得y=1.5,
所以水蒸气的转化率为
=25%,
答:水蒸气的转化率25%.
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
| 1.2×1.2 |
| 0.8×1.8 |
水蒸气的转化率=
| 1.2mol/L |
| 3mol/L |
答:水的转化率为40%;平衡常数为1;
(2)设反应的水蒸气的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 6-x x x
故
| x2 |
| (2-x)(6-x) |
所以水蒸气的转化率为
| 1.5mol/L |
| 6mol/L |
答:水蒸气的转化率25%.
点评:本题考查了用三段式法对化学反应进行计算,难度不大,注意化学平衡常数K的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
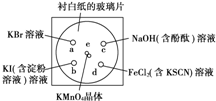 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.