题目内容
下列各组溶液中离子间一定能大量共存的是( )
| A、pH=14的溶液中:K+、Al(OH)4-、SO42- |
| B、水电离出来的c(H+)=10-12mol?L-1的溶液中:K+、Cl-、S2O32- |
| C、有Al3+存在的溶液中:Na+、HCO3-、F- |
| D、滴加甲基橙溶液显红色的溶液中:Ag+、NO2-、ClO3- |
考点:离子共存问题
专题:离子反应专题
分析:离子之间不产生气体、沉淀、弱电解质、络合物、不发生氧化还原反应、不发生双水解的就能共存,据此分析解答.
解答:
解:A.这几种离子之间不反应,所以能共存,故A正确;
B.水电离出来的c(H+)=10-12mol?L-1的溶液为强酸性或强碱性,强酸性条件下,S2O32-易和氢离子反应生成硫单质,所以不能共存,故B错误;
C.有Al3+存在的溶液说明溶液呈酸性,酸性条件下HCO3-不能大量共存,故C错误;
D.滴加甲基橙溶液显红色的溶液说明该溶液呈酸性,酸性条件下NO2-和ClO3-能发生氧化还原反应而不能大量共存,故D错误;
故选A.
B.水电离出来的c(H+)=10-12mol?L-1的溶液为强酸性或强碱性,强酸性条件下,S2O32-易和氢离子反应生成硫单质,所以不能共存,故B错误;
C.有Al3+存在的溶液说明溶液呈酸性,酸性条件下HCO3-不能大量共存,故C错误;
D.滴加甲基橙溶液显红色的溶液说明该溶液呈酸性,酸性条件下NO2-和ClO3-能发生氧化还原反应而不能大量共存,故D错误;
故选A.
点评:本题考查了离子共存,明确离子共存的条件是解本题关键,易错选项是B,水电离出来的c(H+)=10-12mol?L-1的溶液可能是酸性也可能是碱性,很多同学往往认为是碱性而导致错误判断,为易错点.

练习册系列答案
相关题目
下列装置或操作能达到实验目的是( )
A、 制备氢氧化亚铁并观察其颜色 |
B、 用浓硫酸干燥Cl2 |
C、 检查装置气密性 |
D、 利用排空气法收集CO2 |
 某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是
某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是( )
| A、放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B、充电过程中,a极的反应式为:VO2++2H++e-=VO2++H2O |
| C、充电时,b极接直流电源正极,a极接直流电源负极 |
| D、放电时,当转移1.0 mol电子时共有2.0 mol H+从右槽迁移进左槽 |
将一定量的甲烷燃烧后得到CO、CO2和水蒸气,混和气体的质量是49.6g通过无水氯化钙时,无水氯化钙增重25.2g,则CO2的质量是( )
| A、12.5g |
| B、13.2g |
| C、19.7g |
| D、24.4g |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,5.6 g乙烯和环丙烷的混合气体中含有的碳原子数为0.4 NA |
| B、1 mol Cl2通入足量水中反应转移的电子数为NA |
| C、0.1 mol/L Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1 NA |
| D、标准状况下,2.24 L三氯甲烷中含有C-Cl数目为0.3 NA |
下列各组离子,在强碱性溶液中可以大量共存的是( )
| A、Br-.S2-.CO32-.K+ |
| B、Na+.NH4+.Cu2+.NO3- |
| C、Na+.K+.I-.Al3+ |
| D、Ba2+.Fe3+.Cl-.AlO2- |
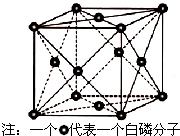 VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题.
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题.
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.