题目内容
9.(1)铜、硝酸银溶液和银组成的原电池装置中,当导线中有0.02mol电子通过时,理论上银片的质量变化了多少?(2)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L•min),且c(A):c(B)=3:5.求:(1)x的值和反应开始前放入容器中A、B的物质的量.
分析 (1)铜、硝酸银溶液和银组成的原电池装置中,铜是负极,银是正极,银上的电极反应为:Ag++e-=Ag,所以当导线中有0.02mol电子通过时,生成0.02mol的银,由此分析解答;
(2)将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
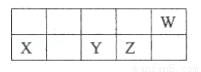
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):n n 0 0
变化量(mol):1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,据此解答.
解答 解:(1)铜、硝酸银溶液和银组成的原电池装置中,铜是负极,银是正极,银上的电极反应为:Ag++e-=Ag,所以当导线中有0.02mol电子通过时,生成0.02mol的银,所以银片的质量变化了0.02mol×108g/mol=2.16g,答:理论上银片的质量变化了2.16g;
(2)将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):n n 0 0
变化量(mol):1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,
C的平均反应速率是0.1mol/(L•min),则:$\frac{\frac{0.5mol}{2L}}{5min}$=0.1mol/(L•min),则x=2,反应开始前容器中的A、B的物质的量n(A)=n(B)=3mol,答:x的值为2和反应开始前放入容器中A、B的物质的量为3mol和3mol.
点评 本题考查化学平衡计算,比较基础,注意掌握三段式解题法在化学平衡计算中应用.

| A. | 20mL0.3 mol•L-1Na2CO3 | B. | 10mL0.4 mol•L-1Na2CO3 | ||
| C. | 25mL0.4 mol•L-1Na2CO3 | D. | 15mL0.5 mol•L-1Na2CO3 |
| A. | 乙烯的结构简式为CH2CH2,乙烷的结构简式为CH3CH3 | |
| B. | 互为同系物的两种化合物具有相同的最简式,且化学性质相似 | |
| C. | 苯和乙烯都可以与溴水、高锰酸钾溶液反应而使它们褪色 | |
| D. | 乙烯分子中所有原子处于同一平面上,乙烷分子为立体结构,原子不都在同一平面上 |
| A. | 负极的反应式为:CH3OH+H2O-6e-═CO2↑+6H+ | |
| B. | 氧气在电极上的反应是O2+4H++4e-═2H2O | |
| C. | 通入甲醇的一极为负极,通入氧气的一极为正极 | |
| D. | 燃料电池的能量转化率能达到100% |