题目内容
10.下列化学用语使用正确的是( )| A. | 甲烷分子的球棍模型: | |
| B. | 羟基的电子式: | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 中子数为54、质子数为92的铀原子14692U |
分析 A.甲烷的球棍模型用小球和短棍表示, 为甲烷的比例模型;
为甲烷的比例模型;
B.羟基为中性原子团, 为氢氧根离子;
为氢氧根离子;
C.乙烯的结构简式中没有标出碳碳双键;
D.元素符号的左上角表示的是质量数,该铀(U)原子的中子数为146.
解答 解:A. 为甲烷的比例模型,甲烷的球棍模型为:
为甲烷的比例模型,甲烷的球棍模型为: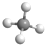 ,故A错误;
,故A错误;
B.氧原子与氢原子通过一对共用电子对连接,羟基中的氧原子含有一个未成对电子,电子式为 ,故B错误;
,故B错误;
C.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故C错误;
D.中子数为54、质子数为92的铀(U)原子的质量数为146,该原子可以表示为:92146U,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构简式、比例模型与球棍模型、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.写出除杂的试剂和方法:
| 试剂 | 方 法 | |
| 乙烷中混有少量乙烯 | ||
| 苯中混有少量甲苯 | ||
| 乙醇中混有少量水 |
1.链状高分子化合物 ,可由有机化工原料R和其它有机试剂,通过加成、水解、氧化、缩聚反应得到,则R是( )
,可由有机化工原料R和其它有机试剂,通过加成、水解、氧化、缩聚反应得到,则R是( )
 ,可由有机化工原料R和其它有机试剂,通过加成、水解、氧化、缩聚反应得到,则R是( )
,可由有机化工原料R和其它有机试剂,通过加成、水解、氧化、缩聚反应得到,则R是( )| A. | 1-丁烯 | B. | 乙烯 | C. | 1,3-丁二烯 | D. | 2-丁烯 |
18.下列各组物质中互为同位素的是( )
| A. | 2040Ca和1840Ar | B. | H2O和H2O2 | C. | D和T | D. | O3和O2 |
5.下列关于乙烯说法正确的是( )
| A. | 乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同 | |
| B. | 工业利用乙烯水化法制乙醇,是发生了取代反应 | |
| C. | 乙烯在空气中燃烧,发生明亮并带有淡蓝色的火焰 | |
| D. | 水果运输中为延长果实的成熟期,常在车厢里放置浸泡过高锰酸钾溶液的硅藻土 |
15.与OH-具有相同质子数和电子数的粒子是( )
| A. | H2O | B. | F- | C. | Na+ | D. | NH3 |
2.下列有关化学用语正确的是( )
| A. | HClO的结构式:H-O-Cl | |
| B. | 比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| D. | NH4Cl的电子式: |
20.如表为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题.
(1)在元素①~⑧中,金属性最强的元素是Na(填元素符号),最不容易形成化合物的元素是Ar(填元素符号).
(2)用电子式表示⑦的气态氢化物的形成过程 .
.
(3)③、④、⑥中原子半径由大到小的顺序是Na>S>F(填元素符号).
(4)表中两种元素的原子按1:1组成的常见液态化合物X易被催化分解.某同学取5支大小相同的试管,各加入等物质的量浓度等体积的X溶液,分别进行下列实验,研究外界条件对X分解反应速率的影响,实验记录如下表所示.
①第一组实验目的是:相同条件下,探究温度对该反应速率的影响.实验2的催化剂A是FeCl3溶液.
②第二组实验中,实验4的温度t是20,发生反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.第二组实验结论是:在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率.
| 族 周期 | IA | 0族 | ||||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(2)用电子式表示⑦的气态氢化物的形成过程
 .
.(3)③、④、⑥中原子半径由大到小的顺序是Na>S>F(填元素符号).
(4)表中两种元素的原子按1:1组成的常见液态化合物X易被催化分解.某同学取5支大小相同的试管,各加入等物质的量浓度等体积的X溶液,分别进行下列实验,研究外界条件对X分解反应速率的影响,实验记录如下表所示.
| 序号 | 条件 | 现象 | 结论 | ||
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
②第二组实验中,实验4的温度t是20,发生反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.第二组实验结论是:在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率.