题目内容
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属,且C的合金用量最大.三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、H C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是 .
(2)写出B与D反应的离子方程式: ,每生成1mol气体甲,转移电子 个.

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A
(2)写出B与D反应的离子方程式:
考点:无机物的推断
专题:推断题
分析:金属A焰色反应为黄色,故A为Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题.
解答:
解:金属A焰色反应为黄色,故A为Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)由上述分析可知,A为Na、H为Fe(OH)3,C(Fe)的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是Fe3O4,
故答案为:Na;Fe(OH)3;Fe3O4;
(2)B与D反应是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,生成1mol氢气,转移电子为2NA,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;2NA.
(1)由上述分析可知,A为Na、H为Fe(OH)3,C(Fe)的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是Fe3O4,
故答案为:Na;Fe(OH)3;Fe3O4;
(2)B与D反应是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,生成1mol氢气,转移电子为2NA,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;2NA.
点评:本题考查无机物推断,涉及Na、Fe、Al元素单质化合物的性质及相互转化,注意特殊的颜色与特殊反应是推断的突破口,难度中等,需要学生熟练掌握元素化合物知识.

练习册系列答案
相关题目
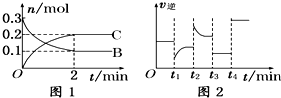 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )| A、t1时改变的条件可能是升高温度 |
| B、t2时改变的条件可能是增大B的浓度 |
| C、t3时改变的条件可能是加压,此时c(B)不变 |
| D、t4时可能是使用了催化剂,此时c(B)不变 |
X、Y、Z、W是元素周期表前四周期中的常见元素.其相关信息如表:下列说法正确的是( )
| 元素 | 相关信息 |
| X | X的一种核素的质量数为14,中子数为8 |
| Y | Y与X同周期,且它的一种氧化物只能用排水法收集 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的原子核外电子总数是其电子层数的4倍 |
| A、原子半径:W>X>Y,离子半径:W>Z |
| B、氧化物对应的水化物的酸性:Z>Y>X |
| C、Y的最高正价含氧酸,可由它的氢化物为原料来制取 |
| D、W的单质与X的一种氧化物不能发生置换反应 |
下列实验装置不适用于物质分离的是( )
A、 |
B、 |
C、 |
D、 |
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应是焓变为负值 | |||
| B、其它条件不变,缩小容器体积,H2浓度一定增大 | |||
| C、升高温度,正反应速率增大,逆反应速率减小 | |||
D、该反应化学方程式为CO+H2O
|
 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间. 金属在人类文明的发展进程中发挥了巨大作用,在人们已知的100多种元素中,金属元素约占80%,以下是关于金属的一些问题,请回答:
金属在人类文明的发展进程中发挥了巨大作用,在人们已知的100多种元素中,金属元素约占80%,以下是关于金属的一些问题,请回答: