题目内容
下列相关反应的离子方程式书写正确的是( )
| A、4molFe 在5molCl2中点燃反应:5Cl2+4Fe═2FeCl2+2FeCl3 |
| B、氯化铁溶液中通入硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| D、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.铁与氯气反应生成氯化铁;
B.三价铁铁离子具有强的氧化性能够氧化硫化氢;
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,反应生成氢氧化铝、硫酸钡和水;
D.NaHCO3溶液中加入过量的Ba(OH)2溶液,反应生成碳酸钡、氢氧化钠和和水.
B.三价铁铁离子具有强的氧化性能够氧化硫化氢;
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,反应生成氢氧化铝、硫酸钡和水;
D.NaHCO3溶液中加入过量的Ba(OH)2溶液,反应生成碳酸钡、氢氧化钠和和水.
解答:
解:A.铁与氯气反应生成氯化铁,与反应物用量无关,方程式为:3Cl2+2Fe
2FeCl3,故A错误;
B.氯化铁溶液中通入硫化氢,反应的离子方程式:2Fe3++H2S═2Fe2++S↓+2H+,故B正确;
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,离子方程式:NH4++Al3++2(SO4)2-+4OH-+2Ba2+=2BaSO4↓+Al(OH)3↓+NH3?H2O,故C错误;
D.NaHCO3溶液中加入过量的Ba(OH)2溶液,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故D错误;
故选:B.
| ||
B.氯化铁溶液中通入硫化氢,反应的离子方程式:2Fe3++H2S═2Fe2++S↓+2H+,故B正确;
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,离子方程式:NH4++Al3++2(SO4)2-+4OH-+2Ba2+=2BaSO4↓+Al(OH)3↓+NH3?H2O,故C错误;
D.NaHCO3溶液中加入过量的Ba(OH)2溶液,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故D错误;
故选:B.
点评:本题考查了离子方程式的书写,题目难度不大,明确反应的事实是解题关键,注意反应物用量对反应的影响,CD为易错选项.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
| A、电池工作时,锌是负极,发生氧化反应 |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| D、电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氩原子的氩气在标准状况下的体积约为11.2 L |
| B、17g 氨气含有的电子数为10NA |
| C、18g D2O中含有的氧原子数为NA |
| D、标准状况下,22.4LCCl4含有的分子数为NA |
1mol物质的含义是( )
| A、0.012 kg碳 |
| B、含有6.02×1023个粒子的物质 |
| C、含有阿伏加德罗常数个粒子的物质 |
| D、含有与6.02×1023个碳原子等质量的物质 |
下列各组离子中因有配合离子生成而不能共存的是( )
| A、K+、Na+、Cl-、NO3- |
| B、Mg2+、Ca2+、SO42-、OH- |
| C、Fe2+、Fe3+、H+、NO3- |
| D、Ba2+、Fe3+、Cl-、SCN- |
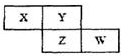 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍