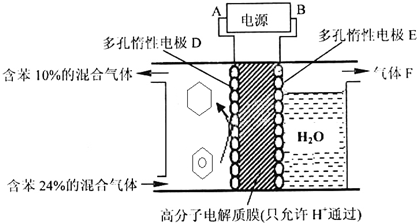
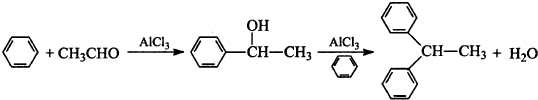
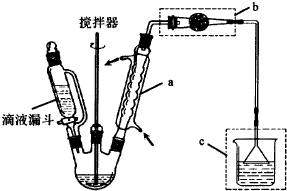
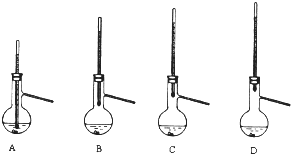
题目内容
19.下列离子方程式正确的是( )| A. | 用CuSO4溶液将ZnS转化成CuS沉淀:S2-+Cu2+═CuS↓ | |
| B. | NH4HCO3溶液与过量NaOH溶液混合加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向酸化的FeSO4溶液中滴入少量H2O2溶液:H2O2+2Fe2++2H+═2Fe3++2H2O | |
| D. | 用惰性电极电解饱和的KCl溶液:2H++2Cl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2 |
分析 A.硫化锌为沉淀,应保留化学式,为可逆过程;
B.氢氧化钠过量,碳酸氢根离子、氨根离子都反应;
C.双氧水能够氧化二价铁离子生成三价铁离子;
D.用惰性电极电解饱和的KCl溶液生成氢氧化钠、氢气和氯气.
解答 解:A.用CuSO4溶液将ZnS转化成CuS沉淀,离子方程式:ZnS+Cu2+CuS+Zn2+,故A错误;
B.NH4HCO3溶液与过量NaOH溶液混合加热,离子方程式:HCO3-+NH${\;}_{4}^{+}$+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,故B错误;
C.向酸化的FeSO4溶液中滴入少量H2O2溶液,离子方程式:H2O2+2Fe2++2H+═2Fe3++2H2O,故C正确;
D.用惰性电极电解饱和的KCl溶液,离子方程式:2H20+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
相关题目
9.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1L0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 1mol单质硅含有2NA个Si-Si键 |
7.化学实验应与化工生产一样遵循绿色化学的原则,实现原料和过程绿色化,下列操作符号绿色化学原则的是( )
| A. | 为便于观察铁在氯气中燃烧的现象,加大氯气的使用量 | |
| B. | 用小铜粒代替可调节高度的铜丝 进行铜和浓硝酸反应的实验 | |
| C. | 焚烧塑料、橡胶等废弃物是处理城市生产、生活垃圾的有效方法 | |
| D. | 用加热H2O2、稀H2SO4和Cu代替加热浓H2SO4和Cu制取CuSO4 |
14.海水提镁的主要流程如图,下列说法正确的是( )


| A. | 流程中的反应全部都是非氧化还原反应 | |
| B. | M是盐酸 | |
| C. | 电解熔融MgO比电解熔融MgCl2制金属镁更节约能量 | |
| D. | 操作b只是过滤 |
4.下列化合物中同分异构体数目最少的是( )
| A. | 乙醇 | B. | 乙酸 | C. | 乙酸乙酯 | D. | 戊烷 |
11.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 常温下,2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.1NA | |
| C. | 在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+数等于NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的分子数均为NA |
9.实验证明,以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3下列说法错误的是( )
| A. | 该反应中氧化剂只有一种 | |
| B. | 该反应中还原产物只有一种 | |
| C. | 被氧化的元素一定是Fe元素 | |
| D. | 该反应中NO和Fe2(SO4)3的物质的量之比为2:3 |