题目内容
 (1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:
(1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:①反应达平衡所需时间:A
②若平衡后,向A、B中分别充入稀有气体,
(2)一定条件下,有反应:X(g)+2Y(g)?2Z(g)△H=Q kJ/mol
①在体积为2L的密闭容器C中,充入1mol X和2mol Y进行反应,2min后反应达到平衡,此时平衡混合物中X为0.8mol,则以Y浓度变化表示的反应速率为
②在恒温恒压条件下,向密闭容器D中充入0.5mol X和1mol Y,达到平衡后Z的物质的量分数为a,如果再向容器中充入0.5mol Z,重新平衡后Z的物质的量分数为b,则a
③如图所示曲线Ⅰ、Ⅱ是该反应在只有一个反应条件不同时Z的体积分数与时间的关系图,下列有关曲线Ⅰ、Ⅱ的叙述,正确的是
A.Ⅰ没有用催化剂,Ⅱ用了催化剂
B.Ⅱ的反应温度比Ⅰ高且Q<0
C.Ⅱ的压强比Ⅰ大
(3)在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应A(s)+2B(g)?C(g)+D(g) 已达平衡状态的是
A、混合气体的压强
B、混合气体的密度
C、B 的物质的量浓度
D、气体的总物质的量.
考点:体积百分含量随温度、压强变化曲线,化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)①A能保持恒容,B能保持恒压,起始时向容积相等的A、B中分别通入充入2mol SO3,使之发生反应:2SO2+O2?2SO3,恒温恒容随反应进行压强增大速率增大,恒温恒压容器中反应过程中体积增大,反应速率小;转化率大;
②恒温恒压容器,加入惰气相当于压强减小,平衡向气体体积增大的方向进行;恒温恒容容器加入惰气总压增大,分压不变,平衡不动,反应速率不变;
(2)①根据反应列三段式进行计算;
②该反应在恒温恒压条件下,只要转化到一边成比例,则平衡状态等效来分析;
③根据先拐先平衡,条件高分析;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
②恒温恒压容器,加入惰气相当于压强减小,平衡向气体体积增大的方向进行;恒温恒容容器加入惰气总压增大,分压不变,平衡不动,反应速率不变;
(2)①根据反应列三段式进行计算;
②该反应在恒温恒压条件下,只要转化到一边成比例,则平衡状态等效来分析;
③根据先拐先平衡,条件高分析;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:(1)①A能保持恒容,B能保持恒压,起始时向容积相等的A、B中分别通入充入2mol SO3,使之发生反应:2SO2+O2?2SO3,恒温恒容随反应进行压强增大速率增大,恒温恒压容器中反应过程中体积增大,反应速率小,转化率大;所以达到平衡所需要的时间A小于B,SO2的转化率A小于B;
故答案为:<;<;
②恒温恒容A容器加入惰气总压增大,分压不变,平衡不动,反应速率不变;恒温恒压B容器,加入惰气相当于压强减小,平衡向气体体积增大的方向进行,反应是气体体积增大的反应,所以平衡正反应进行;
故答案为:B;正反应;
(2)①X(g)+2Y(g)?2Z(g)
开始 1 2 0
转化0.2 0.4 0.4
平衡0.8 1.6 0.4
所以Y浓度变化表示的反应速率为
=0.1mol/(L?min),X的转化率为
×100%=20%,故答案为:0.1mol/(L?min);20%;
②该反应在恒温恒压条件下,只要转化到一边成比例,则平衡状态等效,与向密闭容器D中充入0.5mol X和1mol Y,达到平衡后Z的物质的量分数为a,如果再向容器中充入0.5mol Z相当于充入0.25mol X和1.5mol Y,与原平衡成比例所以等效,所以a=b,故答案为:=;
③根据催化剂不改变平衡移动,所以A错误,先拐先平衡,条件高,则Ⅱ的反应温度比Ⅰ高,再由温度高Z的体积分数反而小,则升温平衡向逆反应方向移动,所以Q<0,故B正确;先拐先平衡,条件高,则Ⅱ的反应压强比Ⅰ高,再由压强高Z的体积分数反而小,则升压平衡向逆反应方向移动与反应不相符,故C错误;故选:B;
(3)A、随着反应的进行体系压强不变,容器内压强保持不变,不一定达平衡状态,故A错误;
B、混合气体的密度不变,说明气体的质量不变,即正逆反应速率相等,故B正确;
C、反应体系中气体的物质的量是一定值,如果混合气体的平均相对分子质量,说明气体总质量不变,达化学平衡状态,故C正确;
D、反应体系中气体的物质的量是一定值,不一定平衡,故D错误;
故选BC.
故答案为:<;<;
②恒温恒容A容器加入惰气总压增大,分压不变,平衡不动,反应速率不变;恒温恒压B容器,加入惰气相当于压强减小,平衡向气体体积增大的方向进行,反应是气体体积增大的反应,所以平衡正反应进行;
故答案为:B;正反应;
(2)①X(g)+2Y(g)?2Z(g)
开始 1 2 0
转化0.2 0.4 0.4
平衡0.8 1.6 0.4
所以Y浓度变化表示的反应速率为
| ||
| 2 |
| 0.2 |
| 1 |
②该反应在恒温恒压条件下,只要转化到一边成比例,则平衡状态等效,与向密闭容器D中充入0.5mol X和1mol Y,达到平衡后Z的物质的量分数为a,如果再向容器中充入0.5mol Z相当于充入0.25mol X和1.5mol Y,与原平衡成比例所以等效,所以a=b,故答案为:=;
③根据催化剂不改变平衡移动,所以A错误,先拐先平衡,条件高,则Ⅱ的反应温度比Ⅰ高,再由温度高Z的体积分数反而小,则升温平衡向逆反应方向移动,所以Q<0,故B正确;先拐先平衡,条件高,则Ⅱ的反应压强比Ⅰ高,再由压强高Z的体积分数反而小,则升压平衡向逆反应方向移动与反应不相符,故C错误;故选:B;
(3)A、随着反应的进行体系压强不变,容器内压强保持不变,不一定达平衡状态,故A错误;
B、混合气体的密度不变,说明气体的质量不变,即正逆反应速率相等,故B正确;
C、反应体系中气体的物质的量是一定值,如果混合气体的平均相对分子质量,说明气体总质量不变,达化学平衡状态,故C正确;
D、反应体系中气体的物质的量是一定值,不一定平衡,故D错误;
故选BC.
点评:本题考查考查化学平衡移动的问题,侧重于化学平衡移动的综合考查,题目难度不大,注意把握平衡常数的意义.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
已知F为高分子化合物:
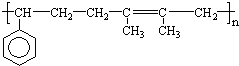
C分子结构中只含有一种氢.
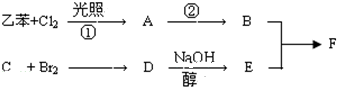
(1)写出下列物质结构简式
B: C: E:
(2)判断①反应类型:
(3)写出②反应进行所需条件:
(4)写出C7H8O所有含苯环结构的同分异构体: .

C分子结构中只含有一种氢.

(1)写出下列物质结构简式
B:
(2)判断①反应类型:
(3)写出②反应进行所需条件:
(4)写出C7H8O所有含苯环结构的同分异构体:
下列说法中,不正确的是( )
| A、钠、钾着火时可用水灭火 |
| B、面粉厂或加油站不必严禁烟火 |
| C、氨气泄漏时可喷洒大量水进行处理 |
| D、皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 |
 为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:
为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下: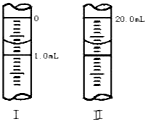 草酸与高锰酸钾在酸性条件下能够发生如下反应:
草酸与高锰酸钾在酸性条件下能够发生如下反应: