��Ŀ����
7��SO2��CO��NO��NH3����ѧ�г����ļ������壮��1������֮��Ϊ32��7��30��ǰ�������壬������֮��Ϊ2��1��4����ԭ����֮��Ϊ4��1��4��
��2����״���£�4.25gNH3�����Ϊ5.6L�������״����8.4L H2S������ͬ��Ŀ����ԭ�ӣ���7.5gNO������ͬ��Ŀ�ĵ�ԭ�ӣ�
��3������״����6.72LSO2ͨ��1L0.6mol/LNaOH��Һ�У�������Һ�����ʵ����ʵ���Ũ��Ϊ0.3mol/L ������ͨ���������Һ����ı仯����
���� ��1������n=$\frac{m}{M}$�����������ʵ���֮�ȣ�������Ŀ֮�ȵ������ʵ���֮�ȣ����ÿ�������к���Oԭ����Ŀ��������ʺ�����ԭ����Ŀ֮�ȣ�
��2������n=$\frac{m}{M}$���㰱�����ʵ������ٸ���V=nVm���㰱����������Hԭ����Ŀ��ȼ����������ʵ������ٸ���V=nVm��������������
��3�������6.72LSO2�����ʵ���Ϊ$\frac{6.72L}{22.4L/mol}$=0.3mol��1L0.6mol•L-1NaOH��Һ��NaOHΪ1L��0.6mol/L=0.6mol���������ʵ���֮��Ϊ0.3mol��0.6mol=1��2��������Ӧ��SO2+2NaOH=Na2SO3+H2O����֪n��Na2SO3��=n��SO2�����ٸ���c=$\frac{n}{V}$����c��Na2SO3����
��� �⣺��1������֮��Ϊ32��7��30����������S02��CO��NO�����ʵ���֮��Ϊ$\frac{32}{64}$��$\frac{7}{28}$��$\frac{30}{30}$=2��1��4�������߷�����֮��Ϊ2��1��4��������ԭ����֮��Ϊ2��2��1��1��4��1=4��1��4��
�ʴ�Ϊ��2��1��4��4��1��4��
��2����״���£�4.25g NH3�����ʵ���Ϊ$\frac{4.25g}{17g/mol}$=0.25mol�������Ϊ0.25mol��22.4L/mol=5.6L����֮������ͬ��Ŀ����ԭ�ӵ�����Ϊ$\frac{0.25mol��3}{2}$=0.375mol����������������Ϊ0.25mol��22.4L/mol=8.4L��4.25g NH3�е�ԭ�ӵ����ʵ���Ϊ��0.25mol��������0.25mol��30g/mol=7.5g��
�ʴ�Ϊ��5.6��8.4��7.5��
��3�������6.72LSO2�����ʵ���Ϊ$\frac{6.72L}{22.4L/mol}$=0.3mol��1L0.6mol•L-1NaOH��Һ��NaOHΪ1L��0.6mol/L=0.6mol���������ʵ���֮��Ϊ0.3mol��0.6mol=1��2��������Ӧ��SO2+2NaOH=Na2SO3+H2O�����õ���������Na2SO3����֪n��Na2SO3��=n��SO2��=0.3mol����c��Na2SO3��=$\frac{0.3mol}{1L}$=0.3mol/L��
�ʴ�Ϊ��0.3��
���� ���⿼�����ʵ����йؼ��㡢��ѧ����ʽ����ȣ��Ƚϻ�����ּ�ڿ���ѧ���Ի���֪ʶ���������գ�

| A�� | Cl2O | B�� | H2SO4 | C�� | C2H5OH | D�� | KNO3 |
��1����ͬѧѡ����ͼ��ʾ�IJ���װ�ã������ظ�ѡ�ã�����ʵ�飬װ���������ӵĺ���˳��ΪA��B��D��C��E��D��F��
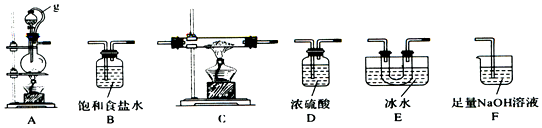
��2��A�з�Ӧ�����ӷ���ʽΪMnO2+2Cl-+4H+$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
��3��ͼ��g�ܵ������DZ�����ѹƽ�⣬���ڷ�Һ©���е�Һ������������ƿ��װ��E ���������������ռ�BC13��
��4��ֹͣʵ�飬��ȷ�IJ�������Ϩ��C���ƾ��ƣ��ٰ�F�����ܣ���Ϩ��A���ƾ��ƣ�
��5��������һԪ���ᣬ�����λ�ѧʽΪNa[B��OH��4������������ˮ�еĵ��뷽��ʽ��H3BO3+H2O�T[B��OH��4]-+H+��
��6��ʵ����ɺ�ijͬѧ��F�У���Һ����0.05mol/LNaC10��0.05mol/LNaCl��0.1mol/LN a0H���μ�Ʒ����Һ��������Һ��ɫ�������ʵ��̽����Һ��ɫ��ԭ�����ڱ��пո��������ݣ����ʵ�鷽����
| ʵ����� | 0.1mol/L NaClO��Һ/mL | 0.1mol/L NaCl��Һ/mL | 0.2mol/L NaOH��Һ/mL | H2O/mL | Ʒ����Һ | ���� |
| �� | 4.0 | 0 | 0 | 4.0 | 3�� | �Ͽ���ɫ |
| �� | 0 | 4.0 | 4.0 | 0 | 3�� | ����ɫ |
| �� | 4.0 | 0 | 4.0 | 0 | 3�� | ������ɫ |
��1����ͬѧ��Ϊ�ⲻ�Ƿ�����ѧ��Ӧ���£�ʹ��Һ���ɫ��������Cl2����ͬѧ��Ϊ���Ƿ�����ѧ��Ӧ���£�ʹ��Һ���ɫ��������Fe3+��������2������Ӧ���ķ��ţ�
��2�����ṩ�����Լ���
A�����Ը��������Һ
B������������Һ
C�����Ȼ�̼
D�����軯����Һ
���ж���λͬѧ���ƶ�����ȷ�ģ��������ַ���������֤��д��ѡ�õ��Լ���ż�ʵ���й۲쵽������
| ��ͬѧ��ȷ | ѡ���Լ� | ʵ������ |
| ��һ�ַ��� | ||
| �ڶ��ַ��� |
| A�� |  2�� | B�� |  2�� | C�� |  3 �� | D�� |  2�� |
| A�� | ˮ����Է�������Ϊ18g/mol | |
| B�� | һ��ˮ���ӵ�����Ϊ18g | |
| C�� | 1molˮ��������18g | |
| D�� | 1molˮ�к���2����ԭ�Ӻ�1����ԭ�� |
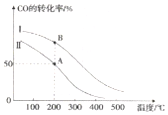 �״�������һ������Դ���ȼ�ϣ�������Ϊ���͵������йط�Ӧ���Ȼ�ѧ����ʽ���£�
�״�������һ������Դ���ȼ�ϣ�������Ϊ���͵������йط�Ӧ���Ȼ�ѧ����ʽ���£�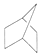 C��CH2=CH-CH=CH2 D��HOOCCH2CH2CH2Cl
C��CH2=CH-CH=CH2 D��HOOCCH2CH2CH2Cl
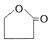 ��E�Ľṹ��ʽNaOOCCH2CH2CH2OH��F������Ԫ�����Ļ�ѧ����ʽHOOCCH2CH2CH2OH$��_{��}^{Ũ����}$
��E�Ľṹ��ʽNaOOCCH2CH2CH2OH��F������Ԫ�����Ļ�ѧ����ʽHOOCCH2CH2CH2OH$��_{��}^{Ũ����}$