题目内容
下列说法符合事实的是
A.常温下由水电离产生的c(H+)=10-12mol/L的溶液中加入铝粉都能够产生氢气
B.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含Cl— 、CrO42—浓度相同的溶液中滴加几滴稀AgNO3溶液时,则先生成AgCl沉淀
C.电解硫酸铜溶液一段时间后,加入氧化铜固体不可能使溶液恢复到原来的浓度
D.在NaAlO2和Na2CO3的混合溶液中逐滴滴加盐酸直至过量,开始没有沉淀,随后产生沉淀,最后沉淀消失
B
【解析】
试题分析:A、常温下由水电离产生的c(H+)=10-12mol/L的溶液既可能呈强酸性由可能呈强碱性,酸性条件下,若溶液中含有硝酸根,加入铝粉不产生氢气,错误;B、由Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12知,在含Cl— 、CrO42—浓度相同的溶液中滴加几滴稀AgNO3溶液时,氯离子沉淀需要的银离子浓度小,则先生成AgCl沉淀,正确;C、电解硫酸铜溶液一段时间后,阴极析出铜,阳极有氧气产生,相当于从溶液中析出氧化铜,故加入氧化铜固体能使溶液恢复到原来的浓度,错误;D、在NaAlO2和Na2CO3的混合溶液中逐滴滴加盐酸直至过量,由于碳酸氢根的酸性大于氢氧化铝,故开始生成氢氧化铝沉淀,错误。
考点:考查水的电离、溶度积常数、电解原理等。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
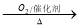 NO2
NO2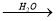 HNO3
HNO3
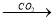 CaCO3
CaCO3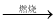 CaO
CaO Al2O3
Al2O3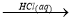 MgCl2(aq)
MgCl2(aq)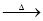 无水MgCl2
无水MgCl2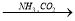 NaHCO3
NaHCO3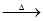 Na2CO3
Na2CO3

