题目内容
(1)已知反应及几种物质中化学键断裂时的能量变化如下所示:
H2(g)+Cl2(g)=2HCl(g) △H=-184kJ/mol
4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g) △H=-115.6kJ/mol
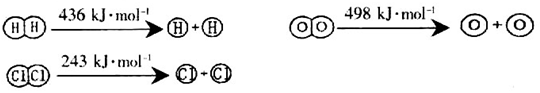
①H2与O2反应生成气态水的热化学方程式为_________________________________;
②断开1mol H—O键所需能量约为_________________________kJ。
(2)已知某反应的平衡常数表达式为:K= ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。
(3)已知反应N2(g)+3H2(g) 2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
A.缩小体积增大压强 B.升高温度
C.加催化剂 D.使氨气液化移走
(4)在一定体积的密闭容器中进行如下化学反应:A(g)+3B(g) 2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
①断送该反应的△H_________0(填“>”或“<”);
②在一定条件下,能判断该反应一定达化学平衡状态的是______(填序号)。
A.3 υ(B)正=2υ(C)逆 B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
H2(g)+Cl2(g)=2HCl(g) △H=-184kJ/mol
4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g) △H=-115.6kJ/mol

①H2与O2反应生成气态水的热化学方程式为_________________________________;
②断开1mol H—O键所需能量约为_________________________kJ。
(2)已知某反应的平衡常数表达式为:K=
 ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。(3)已知反应N2(g)+3H2(g)
 2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。A.缩小体积增大压强 B.升高温度
C.加催化剂 D.使氨气液化移走
(4)在一定体积的密闭容器中进行如下化学反应:A(g)+3B(g)
 2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:| T/K | 300 | 400 | 500 | …… |
| K/(mol·L-1)2 | 4×106 | 8×107 | 1.2×109 | …… |
②在一定条件下,能判断该反应一定达化学平衡状态的是______(填序号)。
A.3 υ(B)正=2υ(C)逆 B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(1)①2H2(g)+O2(g)=2H2O (g) △H=-483.6kJ/mol(2分)②463.4(1分)
(2)C(s)+H2O(g) CO(g)+H2(g)(1分,不标状态不扣分,写成等号不给分)
CO(g)+H2(g)(1分,不标状态不扣分,写成等号不给分)
(3)=(1分);A(1分)(4)①>(1分)②CD(1分)
(2)C(s)+H2O(g)
 CO(g)+H2(g)(1分,不标状态不扣分,写成等号不给分)
CO(g)+H2(g)(1分,不标状态不扣分,写成等号不给分)(3)=(1分);A(1分)(4)①>(1分)②CD(1分)
试题分析:(1)①已知热化学方程式a:H2(g)+Cl2(g)=2HCl(g) △H=-184kJ/mol,b:4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g) △H=-115.6kJ/mol,则根据盖斯定律可知,a×2+b即得到反应2H2(g)+O2(g)=2H2O (g) (g),所以该反应的反应热△H=-184kJ/mol×2-115.6kJ/mol=-483.6kJ/mol。
②断裂1molH-H键需要的能量是436kJ,而断裂1molO=O键需要的能量是498kJ。由于反应热还等于断键吸收的能量和形成化学键所放出的能量的差值,所以根据氢气燃烧的热化学方程式可知2×436kJ+498kJ-2×2×x=-483.6kJ,解得x=463.4kJ,因此断开1mol H—O键所需能量约为463.4kJ。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以依据平衡常数表达式K=
 可知,该反应的方程式为C(s)+H2O(g)
可知,该反应的方程式为C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。(3)一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,其浓度分别是(mol/L)4、2、4。则此时
 =
= =0.5,这说明反应达到平衡状态,所以此时反应υ(N2)正=υ(N2)逆;A、正方应是体积减小的,则缩小体积增大压强,反应速率加快,平衡向正反应方向移动,氨气的含量增大,A正确;B、正方应是放热反应,升高温度反应速率加快,平衡向逆反应方向移动,氨气含量降低,B不正确;C、加催化剂加快反应速率,但平衡状态不变,氨气含量不变,C不正确;D、使氨气液化移走,平衡向正反应方向移动,但则反应速率降低,D不正确,答案选A。
=0.5,这说明反应达到平衡状态,所以此时反应υ(N2)正=υ(N2)逆;A、正方应是体积减小的,则缩小体积增大压强,反应速率加快,平衡向正反应方向移动,氨气的含量增大,A正确;B、正方应是放热反应,升高温度反应速率加快,平衡向逆反应方向移动,氨气含量降低,B不正确;C、加催化剂加快反应速率,但平衡状态不变,氨气含量不变,C不正确;D、使氨气液化移走,平衡向正反应方向移动,但则反应速率降低,D不正确,答案选A。(4)①根据表中数据可知,随着温度的升高,平衡常数逐渐增大。这说明升高温度平衡向正反应方向进行,所以正方应是吸热反应,即△H>0。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、由于反应速率之比是相应的化学计量数之比,则3 υ(B)正=
 υ(C)正=2υ(C)逆,因此正逆反应速率不等,没有达到平衡状态,A不正确;B、A和B的转化率相等不能说明正逆反应速率相等,即反应不一定达到平衡状态,所以B不正确;C、正方应是体积减小的可逆反应,因此压强始终是减小,所以当容器内压强保持不变时可以说明反应达到平衡状态,C正确;D、密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是减小的,所以当混合气体的密度保持不变时,可以说明反应达到平衡状态,D正确,答案选CD。
υ(C)正=2υ(C)逆,因此正逆反应速率不等,没有达到平衡状态,A不正确;B、A和B的转化率相等不能说明正逆反应速率相等,即反应不一定达到平衡状态,所以B不正确;C、正方应是体积减小的可逆反应,因此压强始终是减小,所以当容器内压强保持不变时可以说明反应达到平衡状态,C正确;D、密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是减小的,所以当混合气体的密度保持不变时,可以说明反应达到平衡状态,D正确,答案选CD。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 H2SO4(aq)+
H2SO4(aq)+ 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol