题目内容
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+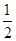 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
Na2O2(s)+CO2(g)=Na2CO3(s)+
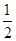 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol根据以上热化学方程式判断,下列说法错误的是
| A.CO的燃烧热为283 kJ/mol |
B.下图可表示由CO生成CO2的反应过程和能量关系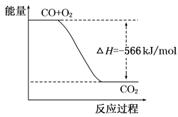 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
B
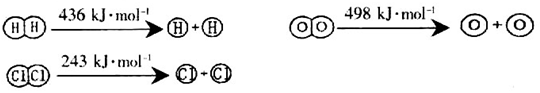
试题分析:A、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol可知,CO的燃烧热=566 kJ/mol ×
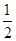 =283 kJ/mol,A正确;B、CO燃烧是放热反应,反应物的总能量高于生成物的总能量,即2molCO和1mol氧气的总能量比2molCO2的总能量高566kJ。但图像中物质的物质的量不对,因此右图不能表示由CO生成CO2的反应过程和能量关系,B不正确;C、由于气态CO2的总能量高于固态CO2的总能量,所以过氧化钠与固态CO2反应放出的热量少。由于放热越多,△H越小,所以根据Na2O2(s)+CO2(g)=Na2CO3(s)+
=283 kJ/mol,A正确;B、CO燃烧是放热反应,反应物的总能量高于生成物的总能量,即2molCO和1mol氧气的总能量比2molCO2的总能量高566kJ。但图像中物质的物质的量不对,因此右图不能表示由CO生成CO2的反应过程和能量关系,B不正确;C、由于气态CO2的总能量高于固态CO2的总能量,所以过氧化钠与固态CO2反应放出的热量少。由于放热越多,△H越小,所以根据Na2O2(s)+CO2(g)=Na2CO3(s)+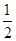 O2(g) ΔH=-226 kJ/mol可知,2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol,C正确;D、已知①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol、②Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g) ΔH=-226 kJ/mol可知,2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol,C正确;D、已知①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol、②Na2O2(s)+CO2(g)=Na2CO3(s)+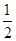 O2(g) ΔH=-226 kJ/mol,则根据盖斯定律可知①×
O2(g) ΔH=-226 kJ/mol,则根据盖斯定律可知①×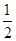 +②即得到Na2O2(s)+CO(g)=Na2CO3(s),所以该反应的反应热△H=-566 kJ/mol×
+②即得到Na2O2(s)+CO(g)=Na2CO3(s),所以该反应的反应热△H=-566 kJ/mol×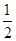 -226 kJ/mol=-509kJ/mol。在反应中碳元素化合价从+2价升高到+4价,失去2个电子。因此CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023,D正确,答案选B。
-226 kJ/mol=-509kJ/mol。在反应中碳元素化合价从+2价升高到+4价,失去2个电子。因此CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023,D正确,答案选B。
练习册系列答案
相关题目
 O2(g)=CO2(g)+2H2(g)
O2(g)=CO2(g)+2H2(g)
 ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。 2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

 C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定
C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定