题目内容
【题目】升高温度,下列数据不一定增大的是
A. 化学反应速率vB. AgCl的溶度积Ksp(AgCl)
C. 化学平衡常数KD. 水的离子积Kw
【答案】C
【解析】
根据温度对化学反应速率、沉淀溶解平衡、化学平衡、水的电离平衡的影响分析。
A项:升高温度,化学反应速率加快,A项错误;
B项:AgCl等大多数物质的沉淀溶解是吸热过程,升高温度,其溶度积Ksp(AgCl)增大,B项错误;
C项:对于正反应吸热的可逆反应,升高温度,平衡右移,化学平衡常数K增大。对于正反应放热的可逆反应,升高温度,平衡左移,化学平衡常数K减小。C项正确;
D项:水的电离过程吸热,升高温度,水的电离平衡右移,水的离子积Kw增大,D项错误。
本题选C。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】高纯六水氯化锶晶体(SrCl26H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为: 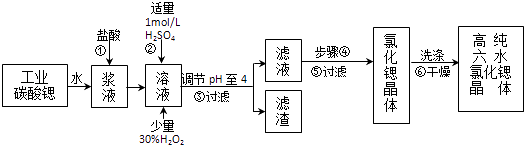
已知:Ⅰ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有(写一种).碳酸锶与盐酸反应的离子方程式 .
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+ , 其离子方程式为 .
(3)在步骤②﹣③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为
A.氨水
B.氢氧化锶粉末
C.氢氧化钠
D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是(填化学式).
(5)步骤④的操作是、 .
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃
B.70~80℃
C.80~100℃
D.100℃以上.