题目内容
【题目】将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1molL﹣1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(1)写出OA段所发生反应的离子方程式、
(2)当加入35mL盐酸时,产生CO2的体积为mL(标准状况).
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数. 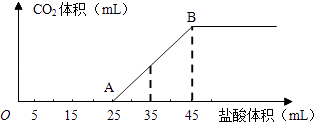
【答案】
(1)H++OH﹣═H2O;CO32﹣+H+═HCO3﹣
(2)224
(3)解:设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
①x+y=1mol/L×(0.045﹣0.025)L
②x+z=1mol/L×0.025L
③84g/moly+106g/molx+40g/molz=2.5g
联立①②③式解得x=0.01mol,y=0.01mol,z=0.015mol
故NaOH的质量为0.015mol×40g/mol=0.6g,
Na2CO3的质量分数为 ![]() ,
,
答:原混合物中NaOH的质量为0.6g,碳酸钠的质量分数为42.4%
【解析】解:(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段0~5mL先发生酸碱中和, 其离子反应方程式为H++OH﹣═H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为CO32﹣+H+═HCO3﹣ ,
所以答案是:H++OH﹣═H2O;CO32﹣+H+═HCO3﹣;(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(35﹣25)×10﹣3L×1molL﹣1=0.01mol,则
HCO3﹣+H+═ | CO2↑+H2O |
1 | 1 |
0.01mol | n |
![]() ,解得n=0.01mol,标准状况下其体积为0.01mol×22.4L/mol=0.224L=224mL,
,解得n=0.01mol,标准状况下其体积为0.01mol×22.4L/mol=0.224L=224mL,
所以答案是:224;

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如图:
CH3CH2CH2CH2OH ![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如表:
沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移到B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,(填“能”或“否”)将Na2Cr2O7溶液加到浓硫酸中.
(2)正丁醇在Cu/Ag,O2、加热条件下也可氧化为丁醛,反应的化学方程式为 .
(3)上述装置图中,D仪器的名称是 . 加入沸石的作用是 . 若加热后发现未加沸石,应采取的正确方法是 .
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号).
A.润湿
B.干燥
C.检漏
D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在层(填“上”或“下”).
(6)本实验中,正丁醛的产率为%.(相对原子质量:C 12 H 1 O 16)