题目内容
【题目】含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)N2O在金粉表面发生热分解反应:2N2O(g)![]() 2N2(g)+O2(g) H
2N2(g)+O2(g) H
己知:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) H1
2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) H2
H=____(用含H1、H2的代数式表示)。
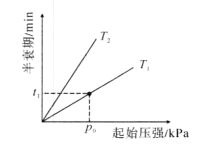
(2)一氧化二氮可反生2N2O(g)![]() 2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
(3)将NH3与O2按体积比4:5充入刚性容器中,起始体系总压强为P0kPa,分别在催化剂M、N作用下发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) H3=-905.0kJ/mol,NH3的分压(P)与时间和温度的关系如图所示:
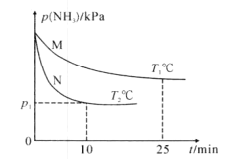
①催化剂的催化效果:M____N(填“强于”或“弱于”)。
②T°C时,0~12.5min内P(NH3)减小量___(填“>”、“=”或“<”)12.5~25min内P(NH3)减小量,理由为___。
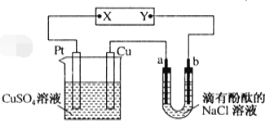
(4)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图所示。
①交换膜应选用___(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____。

【答案】![]() △H2-
△H2-![]() △H1 > 1.25p0 弱与 > 反应物的浓度逐渐减小,反应速率减慢 阳离子交换膜 2Cl--2e-=Cl2↑
△H1 > 1.25p0 弱与 > 反应物的浓度逐渐减小,反应速率减慢 阳离子交换膜 2Cl--2e-=Cl2↑
【解析】
(1)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H1
②2NH3(g)+3N2O(g)=4N2(g)+3H2O(1)△H2
盖斯定律计算(②×2-①)×![]() 得到N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g)△H=
得到N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g)△H=![]() △H2-
△H2-![]() △H1;
△H1;
(2)温度越高,反应越快,半衰期越短,等压强p0下可以看出T2下的半衰期长因此T1大于T2;
压强之比等于物质的量之比,半衰期指的是任一浓度N2O消耗一半所需要的时间,由反应方程式可知,设起始时有2molN2O,t1时生成1mol N2和0.5mol O2,还剩1molN2O,故混合气体的总物质的量为(1+0.5+1)mol=2.5mol,因此在T1、p0下反应后的物质的量是起始的1.25倍,故p=1.25p0;
(3)①该反应焓变小于0,正反应为放热反应,温度越高平衡左移,氨气的平衡分压越高,所以T1>T2,据图可知在N催化剂的作用下温度较低的反应先达到平衡,说明M的催化效果弱与N的催化效果;
②随着反应进行,反应物的浓度逐渐减小,反应速率减慢,所以0~12.5min内P(NH3)减小量大于12.5~25min内P(NH3)减小量;
(4)①由ClO2→NaClO2可知,Cl的化合价降低,所以ClO2发生失去电子的氧化反应,即A电极为电解池的阴极,电极反应式为ClO2+e-=ClO2-,结合Na+生成NaClO2,所以钠离子由阳极区移向阴极区,则离子交换膜为阳离子交换膜;
②阳极区Cl-失去电子生成Cl2,电极反应式为2Cl--2e-=Cl2↑。