题目内容
16.25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为Na2CO3>NaCN>CH3COONa.(填化学式)分析 相同温度下,相同浓度的不同钠盐溶液,弱酸根离子水解程度越大,该钠盐溶液的pH越大,据此分析解答.
解答 解:相同温度下,相同浓度的不同钠盐溶液,弱酸根离子水解程度越大,该钠盐溶液的pH越大,这几种钠盐溶液中酸根离子水解程度大小顺序是CO32->CN->CH3COO-,所以这三种钠盐溶液的pH大小顺序是Na2CO3>NaCN>CH3COONa,
故答案为:Na2CO3>NaCN>CH3COONa.
点评 本题考查盐类水解,为高频考点,侧重考查学生分析判断能力,明确酸根离子水解程度与其相对应的酸酸性强弱关系是解本题关键,注意:碳酸根离子相对应的酸是HCO3-而不是H2CO3.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
9.现代以石油化工为基础的三大合成材料是①合成氨、②塑料、③合成橡胶、④合成尿素、⑤合成纤维、⑥合成洗涤剂( )
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ②③⑤ |
9.已知外电路中,电子由b极流向锌.有关如图所示的装置分析不合理的是( )


| A. | 该装置中Cu极为正极 | |
| B. | 当铜极的质量变化为32 g时,a极上消耗的O2在标准状况下的体积为5.6 L | |
| C. | b极反应的电极反应式为H2-2e-+2OH-═2H2O | |
| D. | 一段时间后锌片一极质量增加 |
11.下列物质的分类合理的是( )
| A. | 酸性氧化物:CO、NO2、SO3、H2O | |
| B. | 碱性氧化物:Na2O、CaO、Mn2O7、Na2O2 | |
| C. | 碱:NaOH、Cu2(OH)2CO3、Ba(OH)2、NH3•H2O | |
| D. | 酸:HN3、CH3COOH、H2S、H3PO2 |
9. 已知如表数据:
已知如表数据:
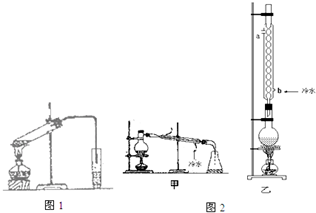
实验室制乙酸乙酯的主要装置如图1所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图1连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡.
(2)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(3)步骤③中,用小火加热试管中的混合液,其原因与结论乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(4)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,写出原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗,产物应从上口倒出,因为乙酸乙酯比水密度小.
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为乙装置合理,因为反应物能冷凝回流.
 已知如表数据:
已知如表数据:| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡.
(2)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(3)步骤③中,用小火加热试管中的混合液,其原因与结论乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(4)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,写出原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗,产物应从上口倒出,因为乙酸乙酯比水密度小.
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为乙装置合理,因为反应物能冷凝回流.
 :2Ag + 2H+=2Ag+ + H2↑
:2Ag + 2H+=2Ag+ + H2↑