题目内容
9.已知外电路中,电子由b极流向锌.有关如图所示的装置分析不合理的是( )
| A. | 该装置中Cu极为正极 | |
| B. | 当铜极的质量变化为32 g时,a极上消耗的O2在标准状况下的体积为5.6 L | |
| C. | b极反应的电极反应式为H2-2e-+2OH-═2H2O | |
| D. | 一段时间后锌片一极质量增加 |
分析 外电路中,电子由铜流向a极,则左图中为原电池,负极b的电极反应为2OH-+H2-2e-=H2O,正极a上发生O2+2H2O+4e-=4OH-;右图为电解池,Cu与正极相连为阳极,发生Cu-2e-=Cu2+,Zn为阴极,发生电极反应为Cu2++2e-=Cu,以此来解答.
解答 解:A.该装置中Cu极为电解池的阳极,故A错误;
B.正极a上发生O2+2H2O+4e-=4OH-,Cu与正极相连为阳极,发生Cu-2e-=Cu2+,由电子守恒可知2Cu~O2,当铜片的质量变化为32g时,n(Cu)=0.5mol,则n(O2)=0.25mol,所以a极上消耗的O2在标准状况下的体积为5.6L,故B正确;
C.电解质为KOH,则b的电极反应为2OH-+H2-2e-=H2O,故C正确;
D.Zn为阴极,发生电极反应为Cu2++2e-=Cu,所以一段时间后锌片质量增加,故D正确;
故选A.
点评 本题考查原电池与电解池,明确电极的判断及发生的电极反应为解答的关键,注意利用电子守恒进行计算,注重基础知识的考查,题目难度不大.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
已知:
表一:不同温度下H3BO3的溶解度
| 温度(℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 金属阳离子 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
(2)“浸取”时为提高速率.除适当增加硫酸浓度外,还可采取的措施是提高反应温度;“浸取”后,采用“热过滤”的目的为防止因温度下降时H3BO3从溶液中析出.
(3)“浸出液”显酸性.含有H3BO3和Mg2+,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质.“除杂”时,向浸出液中依次加入适量的H2O2和MgO,可以除去的杂质离子为Fe3+、Fe2+、Al3+.H2O2的作用为H2O2+2H++2Fe2+=2Fe3++2H2O(用离子方程式表示).
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高.为了从“母液”中充分回收MgSO4•H2O,应采取的措施是将“母液”蒸发浓缩、加压、升温结晶、过滤.
(5)已知25℃时,硼酸(H3BO3)溶液中存在如下平衡:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq) K=5.7×10-10.25℃时,0.7mol/L硼酸溶液中c(H+)=2×10-5mol/L
(6)已知25℃时:
| 化学式 | H2CO3 | HF |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=6.75×10-4 |
A.碳酸钠溶液滴入硼酸溶液中观察到有气泡产生
B.碳酸钠溶液滴入氢氟酸中观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和氟化钠溶液的pH:前者>后者.
| A. | 气体分子的大小 | B. | 气体分子数的多少 | ||
| C. | 气体分子间的平均距离 | D. | 气体分子的相对分子质量 |
| A. | 蔗糖、酒精在水溶液中和熔融态时均不导电,所以它们是非电解质 | |
| B. | SO3、NH3的水溶液均能导电,所以均是电解质 | |
| C. | 钢铁、石墨均导电,所以它们是电解质 | |
| D. | 液态硫酸、固态硫酸钡不能导电,所以二者均不是电解质 |
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、Fe3+、OH-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | Ca2+、Mg2+、HCO3-、CO32- |
| A. | 质量不等、密度相等的N2和C2H4 | B. | 等体积等密度的CO和N2 | ||
| C. | 等温等体积的O2和N2 | D. | 等压等体积的N2和CO2 |
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在10-9-10-7m之间 | |
| B. | FeCl3溶液是电中性的,Fe(OH)3胶体带正电荷 | |
| C. | 胶体的分散质能通过滤纸空隙 | |
| D. | 树林中晨曦的阳光光束现象与丁达尔现象有关 |
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号[ | H | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)该反应的离子方程式为____________________________;
(2)探究温度对化学反应速率影响的实验编号是 ,探究反应物浓度对化 学反应速率影响的实验编号是 ;
学反应速率影响的实验编号是 ;
(3)实验①测得K MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
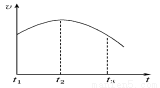
(4)该反应的速率v和时间t的关系如图所示,在t1~t2时段反应速率________(填“加快”或“减慢”或“变化不明显”),主要原因是_____________________。
 2C2O4溶液[
2C2O4溶液[