题目内容
12.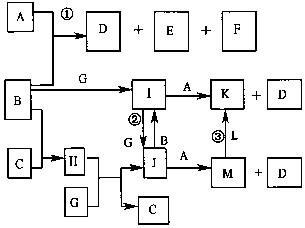 如图是部分元素的单质及其化合物的转化关系图(有关反应的条件己略去);己知:B、C、G、L 均为单质,其中在常温、常压下,G是固体,B、C、L是气体;生成物E具有漂白性,且焰色反应呈黄色;F 在常温下是液体;K、M 均为不溶于水的沉淀,其中K 为红褐色.
如图是部分元素的单质及其化合物的转化关系图(有关反应的条件己略去);己知:B、C、G、L 均为单质,其中在常温、常压下,G是固体,B、C、L是气体;生成物E具有漂白性,且焰色反应呈黄色;F 在常温下是液体;K、M 均为不溶于水的沉淀,其中K 为红褐色.请回答下列问题:
(l)D的电子式:
 ;
;(2)反应①的离子方程式是Cl2+2OH-=ClO-+Cl-+H2O;
(3)反应②的离子方程式是Fe+2Fe3+═3Fe2+;
(4)反应③的化学方程式是4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(5)保存J溶液时还需加入稀HC1和铁屑.
(6)实验室由J制备少量M 的方法:用胶头滴管吸取A溶液,将滴管尖端插入盛有新制J溶液试管底部,慢慢挤出A 溶液即可,观察到的现象为:开始析出一种白色的絮状沉淀,然后迅速变成灰绿色,最后变成红褐色;这样操作的理由是避免生成的Fe(OH)2沉淀接触O2.
分析 K、M 均为不溶于水的沉淀,其中K为红褐色,应为Fe(OH)3,则M为Fe(OH)2,M与L生成K,则L为O2,K由A、I生成,M由A、J生成,I、J又能相互转化,则A为NaOH,I为FeCl3,J为FeCl2,B为Cl2,G为Fe,D为NaCl,又A和B反应生成D、E和F,则E为NaClO,F为H2O,B和C反应生成H,又B、C是气体,所以C为H2,H为HCl,结合对应物质的性质以及题目要求解答该题.
解答 解:(l)由以上分析可知D为NaCl,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(2)反应①为氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式是Cl2+2OH-=ClO-+Cl-+H2O,故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)反应②为FeCl3生成FeCl2的反应,离子方程式为Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+═3Fe2+;
(4)反应③为Fe(OH)2转化成Fe(OH)3,化学方程式是4Fe(OH)2+O2+2H2O═4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(5)由以上分析可知J为FeCl2溶液,在空气中易被氧化生成FeCl3,又易发生水解生成氢氧化亚铁和氯化氢,则保存J溶液时还需加入稀HC1和铁屑,故答案为:稀HC1和铁屑;
(6)实验室由J制备少量M 的方法:用胶头滴管吸取A溶液,将滴管尖端插入盛有新制J溶液试管底部,慢慢挤出A溶液,首先发生反应生成Fe(OH)2,Fe(OH)2不稳定,易被氧化生成红棕色的氢氧化铁,则可观察到开始析出一种白色的絮状沉淀,然后迅速变成灰绿色,最后变成红褐色;这样操作的理由是避免生成的Fe(OH)2沉淀接触O2,故答案为:开始析出一种白色的絮状沉淀,然后迅速变成灰绿色,最后变成红褐色;避免生成的Fe(OH)2沉淀接触O2.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握推断题目的突破口,掌握相关物质的特性以及应用,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 碘的升华 | B. | 生石灰溶于水 | ||
| C. | 酸碱中和 | D. | Ba(OH)2•8H2O与NH4Cl晶体混合 |
| A. | 含1molFeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 1 ml的水分子与1 mol的氢氧根离子所含电子数均为10NA | |
| C. | 常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA | |
| D. | 在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA |
| A. | C+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2 | B. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | Cl2+H2O?HCl+HClO | D. | SO3+H2O=H2SO4 |
| A. | 16 | B. | 16 g•mol-1 | C. | 32 | D. | 32 g•mol-1 |
| A. | 家庭中经常用食醋浸泡有水垢的水壶 | |
| B. | 甘油加水作护肤剂 | |
| C. | 交通警察用酸性重铬酸钾检查司机是否酒后驾车 | |
| D. | 烹鱼时,加入少量的料酒和食醋可减少腥味,增加香味 |
 板:2Fe3++Cu=2Fe2++Cu2+
板:2Fe3++Cu=2Fe2++Cu2+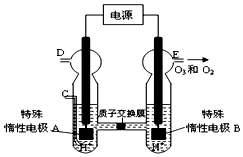 过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题:
过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题: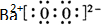 (写电子式),
(写电子式), 2Z(g)ΔH<0。为了使平衡向生成Z 的方向移动,应选择的条件是( )
2Z(g)ΔH<0。为了使平衡向生成Z 的方向移动,应选择的条件是( )