题目内容
1.下列说法正确的是( )| A. | 等体积、等物质的量浓度的强酸中所含的H+数目一定相等 | |
| B. | 1L二氧化碳气体一定比1L氧气的质量大 | |
| C. | 同温同压下,相同体积的物质,它们的物质的量必定相等 | |
| D. | 任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必定相等 |
分析 A、强酸中所含的H+数目取决于酸的体积、物质的量浓度以及酸为几元酸等情况;
B、根据m=nM=$\frac{V}{{V}_{m}}$M来回答;
C、根据阿伏加德罗定律的内容或n=$\frac{V}{{V}_{m}}$来回答;
D、根据阿伏加德罗定律的内容或N=nNA来回答.
解答 解:A、体积、等物质的量浓度的盐酸和硫酸中所含的H+数目一定不相等,故A错误;
B、根据m=nM=$\frac{V}{{V}_{m}}$M,二氧化碳和氧气的体积相等,M(CO)<M(CO2),但是它们的Vm的大小无法确定,所以质量无法计算,故B错误;
C、根据公式n=$\frac{V}{{V}_{m}}$,同温同压下,则Vm相同,再加上体积相同,所以它们的物质的量相同,该结论只适用于气体物质,故C错误;
D、根据公式N=nNA,乙烯和一氧化碳的物质的量相等,所以分子数必相等,故D正确;
故选D.
点评 本题考查阿伏加德罗定律的推论以及物质的量的相关计算知识,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.有容积不同的X、Y两密闭容器,X中充满CO气体,Y中充满CH4、O2、N2的混合气体,同温同压下测得两容器中气体的密度相同.下列叙述中不正确的是( )
| A. | 两容器中所含气体分子数一定不同 | |
| B. | 两容器中所含气体的质量一定不同 | |
| C. | Y容器中CH4、O2、N2的质量之比可以为1:6:3 | |
| D. | Y容器中CH4、O2、N2的物质的质量之比一定为1:3:6 |
9.下列说法正确的是( )
| A. | 标准状况下,1mol H2完全燃烧生成气态水放出285.8kJ热量,则H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后最高温度 | |
| C. | 在101 kPa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
6.下列有关物质用途的说法中,不正确的是( )
| A. | 液氨可做致冷剂 | |
| B. | 二氧化硅可作为半导体材料 | |
| C. | 氢氧化铝常用于中和胃酸 | |
| D. | 常温下,铁制容器常用于盛装浓硫酸 |
13.如图各情况,在其中Fe片腐蚀由快到慢的顺序是( )
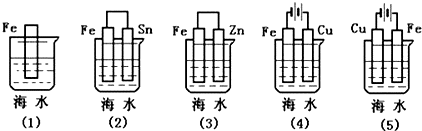

| A. | (5)(2)(1)(3)(4) | B. | (5)(2)(3)(1)(4) | C. | (4)(2)(1)(3)(5) | D. | (4)(2)(1)(5)(3) |
11.两种金属混合物共15g,投入足量的盐酸中,充分反应得11.2L H2(标准状况),则原混合物组成中肯定不能为下列的( )
| A. | Mg、Ag | B. | Fe、Mg | C. | Al、Zn | D. | Mg、Al |
 现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题:
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题: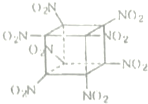 .
.