题目内容
8.某物质含有3.01×1022个分子,其质量为1.4g,则物质的相对分子质量为28.若只含有一种元素,则分子式为:N2.分析 根据n=$\frac{N}{{N}_{A}}$计算出3.01×1022个分子的物质的量,然后根据M=$\frac{m}{n}$计算出其摩尔质量,从而可知其相对分子质量;若只含有一种元素,根据计算结果进行判断该物质的分子式.
解答 解:3.01×1022个分子的物质的量为:$\frac{3.01×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.05mol,该物质的摩尔质量为:$\frac{1.4g}{0.05mol}$=28g/mol,该物质的相对分子质量为28;
若只含有一种元素,其相对分子质量为28,可能为Si或N2,由于Si单质巍峨原子晶体,不存在分子,则满足条件的物质的分子式应该为N2,
故答案为:28;N2.
点评 本题考查了物质的量的计算,题目难度不大,注意掌握物质的量与摩尔质量、阿伏伽德罗常数之间的关系,明确相对分子质量与摩尔质量的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列物质中,既有离子键,又含有共价键的物质是( )
| A. | H2SO4 | B. | CO2 | C. | NaOH | D. | HNO3 |
3.下列关于平衡体系的各说法中不正确的是( )
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 在H2S?H++HS-的平衡体系升温到100℃时,溶液中的c(H+)一定增大 | |
| D. | 在盐酸中加入KCl晶体,溶液pH不变 |
13.下列各组混合物中,可以用分液漏斗分离的是( )
| A. | 酒精和水 | B. | 苯和乙醇 | C. | 硝基苯和水 | D. | 己烷和溴苯 |
20.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.据此下列叙述不正确的是( )
| A. | 该反应是吸热反应 | |
| B. | 生成物的总能量低于反应物的总能量 | |
| C. | 导致醋酸凝固的原因:该反应吸热使大烧杯中的热能转化为小烧杯中产物的内能 | |
| D. | 该反应的热化学方程式为:NH4HCO3(s)+HCl(aq)=NH4Cl(aq)+CO2(g)+H2O(l)△H=+Q kJ•mol-1 |
17.下列有机物的命名正确的是( )
| A. | 二溴乙烷:Br2-CH2-CH2-Br | B. | 3,3,4-三甲基己烷: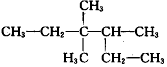 | ||
| C. | 3乙基1丁烯: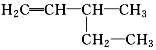 | D. | 2,2,3三甲基戊烷: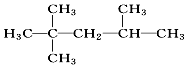 |
