题目内容
2.纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2.CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2.其制备过程如下:
回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl或CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl.为了控制沉淀温度为0℃左右,在实验室宜采取的方法是冰水浴冷却(或将反应容器浸泡在冰水中).
(2)该制法的副产品为NH4Cl(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是A.
(3)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加稀硝酸酸化的硝酸银溶液.
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:用浓度为c mol/L的Na2S2O3溶液进行滴定,消耗Na2S2O3溶液V mL.
(已知:I2+2S2O32-=2I-+S4O62-)
①第三步中滴定终点的现象是溶液由蓝色变为无色,且30s不恢复;
②CaO2的质量分数为$\frac{35cV×1{0}^{-3}}{a}$(用字母表示).
(5)已知CaO2在350℃迅速分解生成CaO和O2.某实验小组设计如图装置测定产品中CaO2含量(夹持装置省略).

①若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为$\frac{9V}{14m}$% (用字母表示).
②CaO2的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量.
分析 (1)实验的目的为制备CaO2•8H2O,则流程中的沉淀应为CaO2•8H2O,根据质量守恒判断还应有NH4Cl生成,根据质量守恒定律可写出反应的化学方程式;CaO2•8H2O在0℃时稳定,为了控制沉淀温度为0℃左右,在实验室宜采取的方法是冰水浴冷却可以达到实验目的;
(2)反应物中氨水过量,为充分回收副产品,应加入盐酸吸收;
(3)据检验Cl-离子的方法,可用稀硝酸酸化的硝酸银溶液检验;
(4)根据反应的离子方程式,CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式CaO2~2S2O32-,并以此进行计算;
(5)①根据过氧化钙和氧气之间的关系式计算;
②过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量.
解答 解:(1)本实验的目的为制备CaO2•8H2O,则流程中的沉淀应为CaO2•8H2O,根据质量守恒判断还应有NH4Cl生成,故可写出反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl或CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
CaO2•8H2O在0℃时稳定,为了控制沉淀温度为0℃左右,在实验室宜采取的方法是冰水浴冷却可以达到实验目的,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl或CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;冰水浴冷却(或将反应容器浸泡在冰水中);
(2)根据反应反应方程式可判断该反应生成CaO2•8H2O和NH4Cl,反应物中氨水过量,为充分回收副产品,应加入盐酸吸收,
故答案为:NH4Cl;A;
(3)滤液中含有大量的Cl-离子,为将沉淀洗涤干净,应充分洗涤,根据检验Cl-离子的方法,可用稀硝酸酸化的硝酸银溶液检验,反应的离子方程式为:Cl-+Ag+═AgCl↓,故答案为:稀硝酸酸化的硝酸银溶液;
(4)①CaO2具有强氧化性,溶液中加入KI晶体和淀粉溶液,生成的碘单质遇淀粉变蓝色,反应的离子方程式为:CaO2+4H++2I-═Ca2++2H2O+I2,
故答案为:溶液由蓝色变为无色,且30s不恢复;
②根据反应的离子方程式,CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式并以此进行计算:
CaO2~2S2O32-
72g 2mol
m cV×10-3mol
m=$\frac{72g×cV×1{0}^{-3}mol}{2mol}$=36cV×10-3g
则CaO2的质量分数为:$\frac{35cV×1{0}^{-3}}{a}$,
故答案为:$\frac{35cV×1{0}^{-3}}{a}$;
(5)①设超氧化钙质量为x,
2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑
144g 22.4L
x 10-3VL
144g:22.4L=x:10-3VL
x=$\frac{144g×1{0}^{-3}VL}{22.4L}$=$\frac{144V}{22400}$g=$\frac{9V}{1400}$,
其质量分数=$\frac{\frac{9V}{1400}g}{mg}$×100%=$\frac{9V}{14m}$%,
故答案为:$\frac{9V}{14m}$%;
②过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量,
故答案为:样品质量和反应后固体质量.
点评 本题考查制备实验方案评价,为高频考点,侧重考查离子检验、化学反应方程式的书写、物质含量测定等知识点,明确实验原理及物质性质是解本题关键,难点是题给信息的挖掘和运用,试题有利于提高学生的分析能力及化学实验能力.

| A. | 向饱和碳酸钠溶液中通入二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| B. | 二氧化锰与浓盐酸反应:MnO2+4HCl(浓)═Mn2++2Cl2↑+2H2O | |
| C. | 亚硫酸氢钠溶液中加过量澄清石灰水:2HSO3-+Ca2++2OH-═CaSO3↓+2H2O+SO32- | |
| D. | 金属钠与硫酸铜溶液反应:2Na+2H2O+Cu2+$\frac{\underline{\;\;△\;\;}}{\;}$2Na++Cu(OH)2↓+H2↑ |
 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)?CO(g)+3H2(g).
 尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
尿素[CO(NH2)2]是首个由无机物人工合成的有机物. +CH2═CH-M$→_{碱}^{Pb}$
+CH2═CH-M$→_{碱}^{Pb}$ =CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
=CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: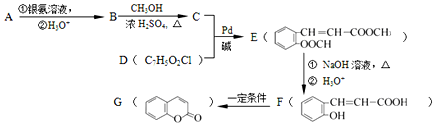
 .
. 中任意2种.
中任意2种. 的路线流程图:
的路线流程图: .
.