题目内容
4.将一定浓度的硝酸钠和氯化钾混合溶液加热至沸腾,有晶体A析出.趁热过滤,分离出晶体A.将上述滤液冷却至室温,又有晶体B析出.(1)晶体A的主要成分是NaCl(填化学式).
(2)晶体B的主要成分是KNO3(填化学式),含有的少量杂质是NaCl(填化学式),要除去晶体B中的少量杂质的方法是重结晶.
(3)用少量热水淋洗晶体也是一种除去晶体中少量杂质的方法,这种方法适用于晶体A(填“A”或“B”).
分析 硝酸钠和氯化钾两种饱和溶液中含有钾离子、钠离子两种阳离子,有氯离子和硝酸根两种阴离子,可能出现硝酸钾、氯化钾、硝酸钠、氯化钠四种物质,对混合液进行蒸发,此时温度较高,而在高温时NaCl的溶解最小,故溶液中的Na+、Cl-将首先结合为NaCl析出,则晶体A为NaCl,过滤后滤液主要含有KNO3,氯化钠和硝酸钾的溶解度不同,可用重结晶的方法分离,以此解答该题.
解答 解:(1)硝酸钠和氯化钾在溶液中以离子存在,由于氯化钠的溶解度最小,则将混合溶液加热至沸腾,首先析出的为NaCl,故答案为:NaCl;
(2)过滤后滤液主要含有KNO3,滤液冷却至室温,析出晶体为KNO3,母液中含有NaCl,可用重结晶的方法分离,故答案为:KNO3;NaCl;重结晶;
(3)因氯化钠的溶解度较小,除去氯化钠,应在温度较高时,在温度较低时溶解度较小,难以除去,故答案为:A.
点评 本题考查物质的分离提纯,为高频考点,侧重溶液析出晶体的考查,解题的关键是掌握不同物质溶解度与温度的关系、掌握常见离子的检验方法是解题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列基态原子或离子的电子排布式错误的是( )
| A. | K:1s22s22p63s23p64s1 | B. | Fˉ:1s22s22p6 | ||
| C. | Fe:1s22s22p63s23p63d54s3 | D. | Kr:1s22s22p63s23p63d104s24p6 |
9.16O与18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 16O2与18O2互为同位素 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O2与18O2间的相互转化 | |
| D. | 标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子 |
13.制印刷电路板的“腐蚀液”的应用原理:2FeCl3+Cu═2FeCl2+CuCl2.向盛有FeCl3溶液的烧杯中同时加入一定量的铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
| A. | 烧杯中有铜、铁均有 | B. | 烧杯中Fe3+、Cu2+、Fe2+均有 | ||
| C. | 烧杯中Cu和Cu2+均有 | D. | 烧杯中Cu2+、Fe2+、Cu和Fe均有 |
 ;
;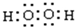 ,
, +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.