题目内容
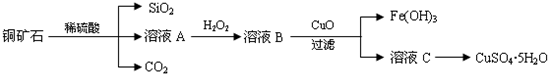
9.碳酸锂广泛应用于陶瓷和医药等领域.以β锂辉石(主要成分为Li2O•Al2O3•4SiO2,含有少量能溶于酸的铁的化合物和镁的化合物)为原料制备Li2CO3的工艺流程如下:提示信息:
①下列四种离子完全沉淀时溶液pH值如下表:
| 金属离子 | 完全沉淀pH |
| Fe2+ | 9.7 |
| Mg2+ | 12.4 |
| Fe3+ | 3.2 |
| Al3+ | 5.2 |
回答下列问题:
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是增加样品与H2SO4的接触面积,加快化学反应速率.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO${\;}_{4}^{2-}$,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入石灰石(填“石灰石”“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,可以除去的离子有Al3+、Fe3+,然后分离得到浸出液.
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有Fe2+、Mg2+、Ca2+.
(4)步骤Ⅲ中,生成沉淀的离子方程式为2Li++CO32-=Li2CO3↓.

分析 已知β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:Li2O•Al2O3•4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂;
(1)从反应速率的角度来分析;
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H2O2是强氧化剂,可把Fe2+氧化成Fe3+,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe2+、Mg2+、Ca2+;
(4)分析Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g可知,Li2CO3最易沉淀.
解答 解:已知β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:Li2O•Al2O3•4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂,
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,故答案为:增加样品与H2SO4的接触面积,加快化学反应速率;
(2)已知Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1,在搅拌下加入石灰石以调节溶液的PH到6.0-6.5,则Fe3+、Al3+转化为氢氧化物沉淀,所以除去的离子为Al3+、Fe3+,故答案为:石灰石;Al3+;Fe3+;
(3)步骤Ⅱ中加入H2O2溶液,可将Fe2+氧化为Fe3+,然后加入石灰乳可除去其中的Fe3+和Mg2+,再加入适量Na2CO3溶液可除去Ca2+.此时溶液中的离子主要有Li+、Na+、SO42-,故答案为:Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀,故答案为:2Li++CO32-=Li2CO3↓.
点评 本题考查了物质分离提纯实验操作,涉及离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等,考查考生运用金属元素的有关知识分析解决问题的能力,题目难度中等,以实验探究的形式考查元素化合物的性质将成为以后高考命题的新亮点.

| A. | 200 mL 0.25mol/L CaCl2溶液 | B. | 200 mL 0.25mol/L HCl溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 100 mL 0.5mol/L MgCl2溶液 |
| A. | 某无色溶液中可能含:SO42-、Br-、OH-、Ba2+ | |
| B. | 使紫色石蕊试液变红色的溶液中可能含:K+、Na+、Ba2+、HCO3- | |
| C. | 某溶液中,加铝粉有氢气放出,溶液中可能含:K+、Na+、H+、NO3- | |
| D. | 在c(H+)=10-14mol/L的溶液中可能含:Na+、AlO2-、CO32-、SO32- |

主要实验方法如下:取一定量的乙酸酐、无水苯和无水AlCl3混合反应,加热回流1小时.反应结束后,按如下的流程分离和提纯.

已知:
| 物质 | 苯乙酮 | 苯 | 乙酸 | 水 |
| 沸点℃ | 202 | 80 | 118 | 100 |
(2)操作Ⅰ为萃取、分液;操作Ⅱ为蒸馏.
(3)操作Ⅰ操作中是否可改用乙醇萃取?否(填“是”或“否”),原因是乙醇与水互溶.
(4)苯乙酮的粗产品中是否含有乙酸?否(填“是”或“否”),原因是在洗涤的操作中,足量5%的氢氧化钠已将乙酸完全中和,进入水层.
(5)若苯乙酮的粗产品中含有低沸点的杂质苯和水,请设计实验方案进行提纯将苯乙酮粗产品进行蒸馏,迅速将温度升高到202℃,收集馏分.
请回答下列问题:
(1)写出仪器A的名称:球形冷凝管;

(2)实验记录如下:
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 烧瓶内溶液由橙黄色变为无色 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
(4)实验室常用Cl2通入NaBr溶液中制得单质溴,工业上常用电解饱和食盐水制备Cl2,装置如图所示,利用该装置,工业上除得到氯气外,还可以得到NaOH,H2(填化学式);装置中的离子交换膜Na+可以通过而OH-不能通过,的目的是避免Cl2与NaOH反应生成NaClO,影响NaOH的产量和纯度.

Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=△H1-△H2+2△H3(用△H1、△H2、△H3)
Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
A.T1℃、前10min,V(NO2)=0.03mol/(L•min)
B.T1℃、反应达化学平衡状态时,CH4的转化率为80%
C.T2℃、反应在40min时处于平衡状态
D.T1>T2
(2)反应的平衡常数K(T1)>K(T2),△H<0,理由是由表中数据可知,T2时反应速率较大,所以T1<T2;升高温度平衡逆向移动,可知K(T1)>K(T2),所以正反应放热.
(3)T1℃时反应的平衡常数K为3.2.
(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2,在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4).
Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-=N2O5.

| 实验目的 | 主要仪器 | 试剂 | |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
 ;
; ;
; 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;