题目内容
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ?mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(2)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极排出液中含有大量的碳酸盐成份,则阳极的电极反应式为
考点:原电池和电解池的工作原理,热化学方程式
专题:电化学专题
分析:(1)根据盖斯定律计算反应热,据此书写该热化学反应方程式;
(2)电解时,阳极排出液中含有大量的碳酸盐成份,根据图知,阳极上还生成氮气,所以阳极是尿素失电子和氢氧根离子反应生成碳酸根离子和氮气、水.
(2)电解时,阳极排出液中含有大量的碳酸盐成份,根据图知,阳极上还生成氮气,所以阳极是尿素失电子和氢氧根离子反应生成碳酸根离子和氮气、水.
解答:
解:(1)①CH4(g)+H2O(g)═CO (g)+3H2(g)△H=+206.2kJ?mol-1,
②CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ?mol-1,
由盖斯定律可知,①×2-②可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),
其反应热△H=(+206.2kJ?mol-1)×2-(+247.4kJ?mol-1)=+165.0 kJ?mol-1,
即热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ?mol-1;
(2)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,且还生成氮气,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,
故答案为:(NH2)2+8OH--6e-═CO32-+N2↑+6H2O.
②CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ?mol-1,
由盖斯定律可知,①×2-②可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),
其反应热△H=(+206.2kJ?mol-1)×2-(+247.4kJ?mol-1)=+165.0 kJ?mol-1,
即热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ?mol-1;
(2)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,且还生成氮气,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,
故答案为:(NH2)2+8OH--6e-═CO32-+N2↑+6H2O.
点评:本题考查了热化学反应及电解原理,根据盖斯定律解答(1),根据图中产物确定阴阳极上发生的电极反应是解本题关键,难点是电极反应式书写,题目难度中等.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
 一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.下列说法不正确的是( )
一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.下列说法不正确的是( )| A、a极为电池的正极 |
| B、电池工作时电流由b极沿导线经灯泡再到a极 |
| C、电池正极的电极反应为:4H++O2+4e-═2H2O |
| D、每消耗1 mol乙醇,反应中转移电子数为6 NA |
化学是以实验为基础的学科,下列有关实验的描述正确的是( )
| A、除去FeCl3溶液中混有的少量FeCl2,可以向其中加入适量的稀硫酸 |
| B、分液时,分液漏斗中下层液体从下口流出后,再关闭活塞,将上层液体从上口倒出 |
| C、向100mL容量瓶中加入4.0g NaOH固体,然后加水到刻度线,配置1.0mol/L的NaOH溶液 |
| D、将(NH4)2SO4,CuSO4溶液分别加入到蛋白质溶液中,都出现沉淀,表明二者均可使蛋白质变性 |
下列对有关实验事实的解释正确的是( )
| A、实验室中的浓硝酸呈现黄色,是因为浓硝酸具有强氧化性 |
| B、加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,原溶液一定有CO32- |
| C、NO和NO2密度比空气大,所以均可用向上排空气法收集 |
| D、在海轮外壳上镶入锌块可减缓船体的腐蚀速率,是利用了原电池的原理 |
下列物质放在空气中,质量不会增加的是( )
| A、硫酸亚铁 | B、浓硝酸 |
| C、浓硫酸 | D、过氧化钠 |
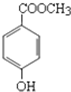 尼泊金酯是一种高效食品防腐剂,其结构简式为:
尼泊金酯是一种高效食品防腐剂,其结构简式为: (一)某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
(一)某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答: