��Ŀ����
12�������裨Si3N4����һ�������մɲ��ϣ�������ʯӢ�뽹̿�ڸ��µĵ������У�ͨ�����·�Ӧ�Ƶã�3SiO2��s��+6C��s��+2N2��g�� $\stackrel{����}{?}$Si3N4��s��+6CO��g��
��1��������Ӧ�����������仯ʾ��ͼ��ͼ1������ͼ���������߱�ʾ�ڷ�Ӧ��ʹ�ô����������ı仯�����
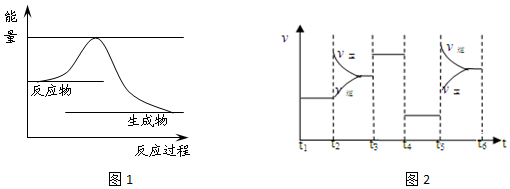
��2���÷�Ӧ��ƽ�ⳣ������ʽΪK=$\frac{{c}^{6}��CO��}{c��{N}_{2}��}$�������¶ȣ���ƽ�ⳣ����С��ѡ���������С�����䡱����
��3���û�ѧ��Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ2��ʾ��t2ʱ����v��ͻ�䡢v�������ԭ���������˵�����Ũ�ȣ�t3����仯������Ϊ���루ʹ�ã��ˣ�����������t5ʱ����v����仯��v��С�仯��ԭ���������¶Ȼ���С���������
���� ��1����Ӧ��ʹ�ô������ܽ��ͷ�Ӧ�Ļ�ܣ������ӿ췴Ӧ���ʣ�
��2��KΪ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���дƽ�ⳣ������ʽʱ������ʹ�Һ���������ʽ����ͼ�з�Ӧ���������������������ܸ߿�֪����ӦΪ���ȷ�Ӧ��
��3��t2ʱ����v��ͻ�䡢v�����䣬���淴Ӧ������ԭ�������нӴ��㣬ֻ���Ǹı�Ũ�ȣ��÷�Ӧ��Ӧǰ����������ı�Ŀ��淴Ӧ��t3�����ı�ʱ���淴Ӧ����ͬ�ȳ̶ȵ�����ֻ���Ǽ��������t5ʱ����v����仯��v��С�仯��ƽ�������ƶ����ı������������ѹǿ�������¶ȣ�
��� �⣺��1��������������ͷ�Ӧ�Ļ�ܣ�����Ӧ�Ȳ��䣬ӦΪ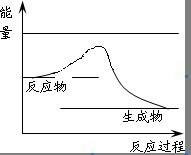 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2����дƽ�ⳣ������ʽʱ������ʹ�Һ���������ʽ������ƽ�ⳣ��K=$\frac{{c}^{6}��CO��}{c��{N}_{2}��}$��������Ӧ���ȣ��������¶�ƽ�������ƶ�����ƽ�ⳣ����С��
�ʴ�Ϊ��$\frac{{c}^{6}��CO��}{c��{N}_{2}��}$����С��
��3��t2ʱ����v��ͻ�䡢v�������ԭ���ǣ������˵�����Ũ�ȣ�ƽ�����������ƶ���v����v����t3ʱ���ʱ��ƽ��δ�ƶ��������ߵĻ�ѧ���������ȣ��ʲ�������ѹǿ��������仯�������Ǽ��루ʹ�ã��ˣ�����������t5ʱ����v����v�������v����v��ƽ�������ƶ����÷�ӦΪ���ȷ�Ӧ����Ϊ�������ķ�Ӧ�����Ա仯��ԭ���������¶Ȼ���С���������
�ʴ�Ϊ�������˵�����Ũ�ȣ����루ʹ�ã��ˣ����������������¶Ȼ���С���������
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬����K�����塢��ѧƽ���ƶ�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ƽ�ⳣ������ʽ�в��ܳ��ֹ��壬��Ŀ�ѶȲ���

| A�� | 12 | B�� | 14 | C�� | 16 | D�� | 18 |
| A�� | ������Һ������������Һ��Ӧ�����ӷ���ʽΪH++OH-=H2O | |
| B�� | H2S��ˮ��Һ�еĵ��룺H2S+H2O?H3O++HS- | |
| C�� | �����ȼ����Ϊ890.3 kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g���TCO2��g��+2H2O ��g����H=-890.3 kJ•mol-1 | |
| D�� | ˫��ˮ�м���ϡ�����KI��Һ��H2O2+2I-+H+�TI2+2H2O |
| A�� | 100mL 0.5 mol/L MgCl2��Һ | B�� | 200mL 0.25 mol/L KCl��Һ | ||
| C�� | 100mL 0.5 mol/L HCl��Һ | D�� | 100mL 0.5 mol/L NaClO��Һ |
| A�� | ���������ܵ�����Ǣܢޢ� | |
| B�� | �����������ڵ���ʵ��Ǣ٢ڢۢܢ��� | |
| C�� | ���ڷǵ���ʵ��Ǣڢݢ� | |
| D�� | ���������У�����ˮ�ܹ�����������Ǣ٢ڢܢݢߢ�� |
 ��
�� H��Ϊ��ʹAl3+ת��ΪAl��OH��3���������2
H��Ϊ��ʹAl3+ת��ΪAl��OH��3���������2 H2O
H2O