题目内容
理论上不能设计为原电池的化学反应是( )
A、CH4(g)+2O2 (g)
| ||||
| B、HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(aq)△H<0 | ||||
C、2H2 (g)+O2(g)
| ||||
| D、2FeCl3(aq)+Fe(s)═3FeCl2 (aq)△H<0 |
考点:原电池和电解池的工作原理
专题:
分析:自发进行的放热的氧化还原反应能设计成原电池,吸热或非氧化还原反应不能设计成原电池,据此分析解答.
解答:
解:A.该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故A不选;
B.该反应中没有电子转移,不属于氧化还原反应,属于复分解反应,所以不能设计成原电池,故B选;
C.该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故C不选;
D.该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故D不选;
故选B.
B.该反应中没有电子转移,不属于氧化还原反应,属于复分解反应,所以不能设计成原电池,故B选;
C.该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故C不选;
D.该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故D不选;
故选B.
点评:本题考查原电池原理,明确原电池反应特点即可解答,注意原电池反应中关键词“自发进行、放热、氧化还原反应”,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
下列方法中,不能实现海水淡化的是( )
| A、过滤法 | B、电渗析法 |
| C、蒸馏法 | D、离子交换法 |
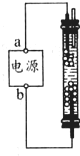 某学生想制作一种家作环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成份判断正确的是( )
某学生想制作一种家作环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成份判断正确的是( )| A、a为正极,b为负极;NaClO和NaCl |
| B、a为负极,b为正极;NaClO和NaCl |
| C、a为阳极,b为阴极;NaClO和NaCl |
| D、a为阳极,b为阴极;NaClO和NaCl |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列“水”电池在海水中放电时的有关说法正确的是( )
| A、正极反应式:Ag+Cl--e-═AgCl |
| B、每生成2 molNa2Mn5O10转移1 mol电子 |
| C、AgCl是还原产物 |
| D、Na+不断向“水”电池的正极移动 |
某元素的一种核素X 的质量数为A,含N个中子,它与1H 原子组成HmX 分子.在a g H mX中所含质子的物质的量是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列有关叙述正确的是( )
| A、分子式相同,元素的百分含量也相同的物质是同种物质 |
| B、通式相同的物质一定是同系物 |
| C、分子式相同的物质一定是同分异构体 |
| D、相对分子质量相同的不同物质一定是同分异构体 |
长期生活在缺碘山区,又得不到碘盐的供给,易患( )
| A、甲状腺机能亢进 |
| B、佝偻病 |
| C、地方性甲状腺肿 |
| D、糖尿病 |
450℃时,密闭容器中,起始时SO2的浓度为0.010mol/L,O2的浓度为0.020mol/L,10s后气体压强为起始时压强的95%,则10s内的平均反应速率是( )
| A、v(O2)=1.5×10-1mol/(L?s) |
| B、v(O2)=1.5×10-4mol/(L?s) |
| C、v(SO2)=3.0×10-3mol/(L?s) |
| D、v(SO3)=3.0×10-5mol/(L?s) |