题目内容
16.下列解释事实的方程式不正确的是( )| A. | 用Na2S除去废水中的Hg2+:Hg2++S2-═HgS↓ | |
| B. | Na在氧气中燃烧产生淡黄色固体:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 | |
| C. | 将NO2通入水中,生成硝酸:3NO2+H2O═2H++2NO3-+NO | |
| D. | Al与NaOH水溶液反应产生气体:Al+OH-+2H2O═Al(OH)3↓+2H2↑ |
分析 A.二者反应生成硫化汞沉淀;
B.钠在氧气中燃烧生成过氧化钠;
C.二氧化氮与水反应生成硝酸和一氧化氮;
D.不符合反应客观事实.
解答 解:A.用Na2S除去废水中的Hg2+,离子方程式:Hg2++S2-═HgS↓,故A正确;
B.钠在氧气中燃烧生成过氧化钠,化学方程式:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,故B 正确;
C.将NO2通入水中,生成硝酸,离子方程:3NO2+H2O═2H++2NO3-+NO,故C正确;
D.铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D错误;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实,遵循原子个数守恒规律,题目难度不大.

练习册系列答案
相关题目
8.古装电视剧中经常有“银针验毒”的剧情,医学上对“银针验毒”的解释是:4Ag+2H2S+O2═Ag2S+2H2O,其中H2S( )
| A. | 是氧化剂 | B. | 是还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂也不是还原剂 |
7.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成CH4燃料电池.已知通入CH4的一
极,其电极反应式是:CH4+10OH--8e-═CO32-+7H2O;下列叙述不正确的是( )
极,其电极反应式是:CH4+10OH--8e-═CO32-+7H2O;下列叙述不正确的是( )
| A. | 通入CH4的电极为负极 | |
| B. | 该电池使用一段时间后应补充KOH | |
| C. | 正极发生氧化反应 | |
| D. | 燃料电池工作时溶液中的阴离子向负极移动 |
4.a、b、c、d是短周期元素,在周期表中的相对位置如图所示.c元素原子核外M层电子数是K层电子数的2倍.下列说法中,错误的是( )
| a | b |
| c | d |
| A. | 原子半径:c>b | |
| B. | 气态氢化物的稳定性:b>d | |
| C. | 高温下,a单质可与c的氧化物发生置换反应 | |
| D. | b的最高价氧化物对应的水化物中既含共价键又含离子键 |
11.关于下列物质用途,错误的是( )
| A. | 氧化铝可做耐火材料 | B. | 过氧化钠可用作潜水艇的供氧剂 | ||
| C. | 单质硅可用作光纤材料 | D. | 碳酸钠可用作食用碱 |
1.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )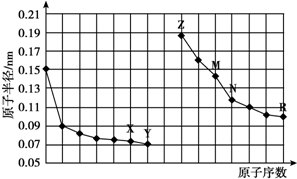

| A. | 简单离子的半径:X<Z<M | |
| B. | Y、R两种元素的气态氢化物稳定性:Y>R | |
| C. | 最高价氧化物对应水化物的酸性:R<N | |
| D. | 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
8.下列反应的离子方程式书写正确的是( )
| A. | 向氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 向硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O═2Fe3++2H2O | |
| C. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | NH4HSO4溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O |