题目内容
3. 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定含有的阳离子是H+、NH4+、Al3+,其对应物质的量浓度之比为2:3:1,一定不存在的阴离子是CO32-、AlO2-;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2$_2^-$+2H2O.
(2)探究二:乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
②当通入Cl2的体积达到11.2L时,溶液中发生的总反应的离子方程式可表示为:5Cl2+6I-+4Br-=10Cl-+3I2+2Br2.
分析 (1)①开始加入2V0无沉淀生成说明发生的反应是:H++OH-═H2O,再加入氢氧化钠溶液至5V0,图象分析可知生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,消耗氢氧化钠溶液3V0,继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应,NH4++OH-?NH3•H2O,消耗氢氧化钠溶液3V0,继续加入氢氧化钠溶液,沉淀开始溶解,到加入10V0氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+H2O,消耗氢氧化钠V0;依据定量关系分析判断离子存在情况和离子物质的量之比;
②沉淀减少是氢氧化铝与过量的氢氧化钠反应生成可溶性偏铝酸钠.
(2)还原性:I->Br-,加入氯气5.6L时溶液中I-amol,则说明通入5.6L Cl2只发生:Cl2+2I-═I2+2Cl-,5.6L变成11.2L,消耗5.6L Cl2的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,发生Cl2+2I-═I2+2Cl-、Cl2 +2Br-═Br2+2Cl-,结合离子反应方程式计算.
解答 解:(1)①根据图象,开始加入NaOH没有沉淀和气体产生,则一定有H+;
由离子共存可知,一定不含有CO32-、AlO2-,开始加入2V0无沉淀生成说明发生的反应是:H++OH-═H2O,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,有Al3+;
再加入氢氧化钠溶液至5V0,图象分析可知生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,消耗氢氧化钠溶液3V0,
继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应,NH4++OH-?NH3•H2O,消耗氢氧化钠溶液3V0,
继续加入氢氧化钠溶液,沉淀开始溶解,到加入10V0氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+H2O,消耗氢氧化钠V0;
沉淀的质量不变,反应为NH4++OH-?NH3•H2O的反应,则有NH4+;
图中反应现象无法确定是否含K+;综上所述一定含有H+、NH4+、Al3+,物质的量之比=2V0:3V0:V0=2:3:1,
故答案为:H+、NH4+、Al3+;2:3:1;CO32-、AlO2-;
②沉淀减少是氢氧化铝与过量的氢氧化钠反应生成可溶性偏铝酸钠,离子方程式为:Al(OH)3+OH-=AlO2$_2^-$+2H2O,故答案为:Al(OH)3+OH-=AlO2$_2^-$+2H2O;
(2)①由于还原性:I->Br-,加入氯气5.6L时溶液中I-xmol,Cl2的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,
Cl2+2I-═I2+2Cl-,
0.25 0.5
消耗n(I-)=2×0.25mol=0.5mol,生成n(Cl-)=2×0.25mol=0.5mol,此时n(Br-)=3.0mol,则说明原溶液中n(Br-)=3.0mol;
5.6L变成11.2L,消耗Cl2的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,发生:Cl2 +2Br-═Br2+2Cl-,Br-消耗3.0-2.6=0.4mol,需要氯气0.2mol,
Cl2 +2Br-═Br2+2Cl-
0.2mol 0.4mol
Cl2 +2I-═I2+2Cl-
0.05mol 0.1mol
则x=0.1mol,所以原溶液中:
n(I-)=0.5mol+0.1mol=0.6mol,
n(Cl-)=2.5mol-0.5mol=2mol,
n(Cl-):n(Br-):n(I-)=2:3:0.6=10:15:3,
故答案为:10:15:3;
②当通入Cl2的体积达到11.2L时,碘离子均被氧化,溴离子部分氧化,由电子、电荷守恒可知离子反应为5Cl2+6I-+4Br-=10Cl-+3I2+2Br2,
故答案为:5Cl2+6I-+4Br-=10Cl-+3I2+2Br2.
点评 本题综合考查离子反应,为高考常见题型,侧重于学生的分析能力考查,注意②中反应的先后顺序为解答的关键,题目难度中等.

| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.2NA | |
| B. | 标准状况下 11.2 L NO与11.2L O2混合,充分反应后所含分子数为0.75NA | |
| C. | 标准状况下,22.4 LCO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
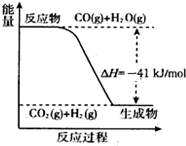 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 |
| K | 2.6 | 1.7 | 1.0 | 0.9 |
(1)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
(2)该反应为放热反应(填“吸热”或“放热”).
(3)增加H2O(g)的浓度,CO的转化率将增大(填“增大”、“减小”或“不变”).
(4)830℃时,向该容器中加入2molCO2与2molH2,平衡时CO2的体积分数是25%.
(5)已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.又已知2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol. 结合图象写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol.
| A. | C4H10 | B. | C2H6O | C. | C3H8O | D. | C2H4O2 |
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | 将SO2通入BaCl2溶液可生成BaS03沉淀 | |
| C. | 将Al 和MgO混合加热到高温可得到单质Mg | |
| D. | 将CO2通入次氯酸钙溶液可生成次氯酸 |
| A. | Al3+、AlO2-、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
| A. | 质量为17 g | |
| B. | 含有6.02×1023个NH3分子 | |
| C. | 标准状况下的体积为44.8 L | |
| D. | 溶于1 L水后,液中NH4+的浓度为2 mol.L-1 |
 .
.