题目内容
12.下列物质中,由极性键形成的非极性分子是( )| A. | CO2 | B. | H2O | C. | CO | D. | CCl4 |
分析 不同种非金属元素的原子间形成极性键,同种非金属元素的原子间形成非极性键;结构对称,正负电荷的中心重合,则为非极性分子,结构不对称,正负电荷的中心不重合,则为极性分子,据此进行判断.
解答 解:A.二氧化碳分子中含有C=O极性键,为线性结构,正负电荷的中心重合,为非极性分子,故A正确;
B.H2O含有H-O极性键,正负电荷的中心不重合,为极性分子,故B错误;
C.CO中含有碳氧极性键,正负电荷的中心不重合,为极性分子,故C错误;
D.CCl4中存在C-Cl极性共价键,分子是正四面体结构,正负电荷的中心重合,为非极性分子,故D正确;
故选:AD.
点评 本题考查化学键的极性和分子极性,明确化学键、分子极性判断的方法是解答本题的关键,注意熟悉常见分子的构型,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1L 0.1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子 | |
| C. | 标准状况下,将22.4L Cl2通入水中发生反应,转移的电子数为NA | |
| D. | 100g 46%的乙醇溶液中,含H-O键的数目为NA |
20.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
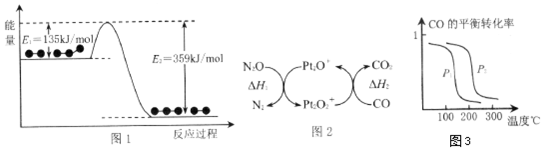
| A. | 12g石墨烯(  )中含有C-C键的数目为1.5NA )中含有C-C键的数目为1.5NA | |
| B. | 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| C. | 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA |
7.A、B、C、D、E为原子序数依次增大的五种短周期元素,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B,C和E形成的化合物在水中均呈碱性.下列说法正确的是( )
| A. | 简单阳离子的氧化性:A<C | |
| B. | 可用含氧酸的酸性比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | A、C、E三种元素形成的化合物既还有离子键又含有共价键 |
17.有aX和2aY两原子,已知2aY原子的M层比aX原子的核外电子数多1,X原子的最外电子层比Y原子的最外电子层的电子数多1.X元素不可能是下列元素中的哪一种元素( )
| A. | Na | B. | Mg | C. | A1 | D. | Cl |
4.分子式为C10H14且苯环上的一氯代物有两种的有机物有( )
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 7种 |
15.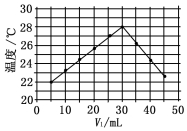 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
16.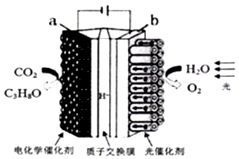 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O | |
| C. | 该装置工作时,H+从b极区向a极区迁移 | |
| D. | 每生成1molO2有44gCO2被还原 |