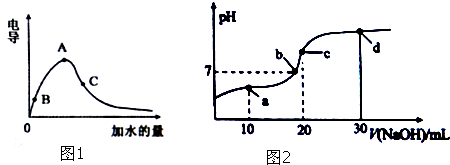
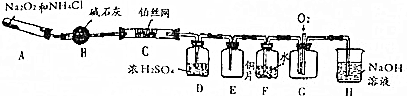
题目内容
12.下列表示对应化学反应的离子方程式正确的是( )| A. | 向漂白液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 用氨水吸收足量二氧化硫:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 用足量的氧氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| D. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
分析 A.碳酸钙为沉淀应保留化学式;
B.二氧化硫足量反应生成亚硫酸氢铵;
C.不符合反应客观事实;
D.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子.
解答 解:A.漂白粉溶液中通入少量CO2的离子方程式为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO,故A错误;
B.用氨水吸收足量二氧化硫,离子方程式:SO2+NH3•H2O═HSO3-+NH4+,故B正确;
C.用足量的氧氧化钠溶液吸收二氧化氮,离子方程式:2NO2+2OH-═2NO3-+NO2-+H2O,故C错误;
D.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故D错误;
故选:B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.(1)CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标.250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g)
①此温度下该反应的平衡常数表达式K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1kJ•mol-1;
(2)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H<0 (填“>”、“=”或“<”).
②300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
①此温度下该反应的平衡常数表达式K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1kJ•mol-1;
(2)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
3.如图所示的装置可用于( )


| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
17.下列叙述不正确的是( )
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 航海船船底四周镶嵌锌块保护船体,利用的是牺牲阳极保护法 | |
| C. | 用铝制铆钉连接铁板,铝钉易被腐蚀 | |
| D. | 原电池中电子由正扱流入负极 |
2.下列有关化学反应的判断不正确的是( )
| A. | BaC03(s)=BaO(s)+CO2(g)在高温下能自发进行,推知△H>0 | |
| B. | 2CO(g)=2C(s)+O2(g)是吸热反应,推知该反应在低温下能自发进行 | |
| C. | 4NH3(g)+5O2(g)=4N0(g)+6H2O(g)是放热反应,推知该反应能自迸行 | |
| D. | N2(g)+3H2(g)=2NH3(g)是熵减的放热反应,推知该反应在低温下能自迸行,但在实际生产中,为了保证反应速率,常采用高温、高压、催化剂等条件 |
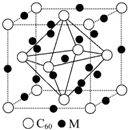 硼及其化合物的研究在无机化学的发展中占有独特的地位.
硼及其化合物的研究在无机化学的发展中占有独特的地位. H++B(OH)4-
H++B(OH)4-