题目内容
13.在一定条件下,CH3COONa 溶液中存在如下水解反应:CH3COO-+H2O?CH3COOH+OH-.下列关于该溶液的说法正确的是( )| A. | 通入CO2,溶液的pH 增大 | |
| B. | 升高温度,该平衡向右移动 | |
| C. | 加水,平衡正向移动,KW 增大 | |
| D. | 加入CH3COONa 固体,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 |
分析 A、通入CO2,溶液的酸性增强,pH 减小;
B、水解是吸热过程,所以升高温度促进水解;
C、加水对水解起促进作用,而水的离子积是温度的函数;
D、$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的分子和分母都乘以氢离子的浓度,原等式为$\frac{c({H}^{+})}{K}$,而温度不变醋酸的电离平衡常数是一个定值,而加入醋酸钠促进水解碱性增强,所以氢离子的浓度减小.
解答 解:A、通入CO2,溶液的酸性增强,pH 减小,而不是增大,故A错误;
B、水解是吸热过程,所以升高温度促进水解,所以水解平衡正向移动,故B正确;
C、加水对水解起促进作用,而水的离子积是温度的函数,温度不变KW不变,故C错误;
D、$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的分子和分母都乘以氢离子的浓度,原等式为$\frac{c({H}^{+})}{K}$,而温度不变醋酸的电离平衡常数是一个定值,而加入醋酸钠促进水解碱性增强,所以氢离子的浓度减小,故D错误;
故选B.
点评 本题考查了水解平衡的影响因素分析判断,学生要清楚水的离子积常数是温度的函数,温度不变其值不变,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.某学习小组为探究MnO2与FeCl3•6H2O的反应,设计了下列装置如图1:
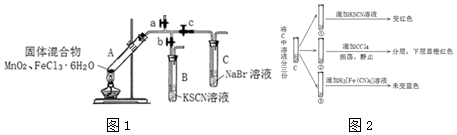
实验前查到信息:
①FeCl3熔点282℃,沸点315℃,FeCl3 $\frac{\underline{\;高温\;}}{\;}$ FeCl2+Cl2↑
②FeCl3•6H2O 熔点37℃,沸点285℃
实验过程记录:
回答下列问题:
(1)A中的白雾是盐酸小液滴.
(2)管壁内形成黄色液滴,可能的原因是FeCl3•6H2O受热气化,在管壁遇冷所致.
(3)B中溶液变红,用化学用语解释原因是Fe3++3SCN-=Fe(SCN)3.
(4)对C中溶液变黄色,小组展开进一步实验如图2:
Ⅰ.C中变黄的原因是Fe3+和Br2共同导致.
Ⅱ.C中发生反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(5)对A中残留物进行分离,其中得到一种不溶于水的红色固体,A中发生化学反应的方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验前查到信息:
①FeCl3熔点282℃,沸点315℃,FeCl3 $\frac{\underline{\;高温\;}}{\;}$ FeCl2+Cl2↑
②FeCl3•6H2O 熔点37℃,沸点285℃
实验过程记录:
| 操作步骤 | 现象 |
| 1检查装置气密性,添加相应药品,点燃酒精灯,开始给A加热 | |
| 2打开a,关闭b、c,用湿润蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
| 3打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
| 4打开c,关闭a、b | C中溶液变棕黄色 |
| 5停止加热 |
(1)A中的白雾是盐酸小液滴.
(2)管壁内形成黄色液滴,可能的原因是FeCl3•6H2O受热气化,在管壁遇冷所致.
(3)B中溶液变红,用化学用语解释原因是Fe3++3SCN-=Fe(SCN)3.
(4)对C中溶液变黄色,小组展开进一步实验如图2:
Ⅰ.C中变黄的原因是Fe3+和Br2共同导致.
Ⅱ.C中发生反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(5)对A中残留物进行分离,其中得到一种不溶于水的红色固体,A中发生化学反应的方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
4.常温下在下列溶液中加入足量的铁,充分反应后,生成气体最多的是( )
| A. | 20mL 12mol•L-1的盐酸 | B. | 10mL 18mol•L-1的硫酸 | ||
| C. | 80mL 2mol•L-1的硫酸 | D. | 40mL 14mol•L-1的硝酸 |
1.铜锌原电池的装置如图所示,下列叙述不正确的是( )


| A. | 锌片为负极,稀硫酸是电解质溶液 | |
| B. | 电池工作时电子由锌片经导线流向铜片 | |
| C. | 电池工作时铜片逐渐溶解而质量减轻 | |
| D. | 电池工作时实现了化学能转化为电能 |
8.下面的“诗”情“化”意,分析正确的是( )
| A. | “粉身碎骨浑不怕,要留清白在人间”只发生了物理变化 | |
| B. | “日照澄州江雾开”中伴有丁达尔效应 | |
| C. | “试玉要烧三日满,辨才须待七年期”中“玉”的成分是硅酸盐,该句诗表明玉的硬度很大 | |
| D. | “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,葡萄糖发生了水解反应 |
18.下列设计的实验方案能达到相应实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| D | 证明氯化银的溶解度大于硫化银的溶解度 | 向2mL0.1mol•L-1硝酸银溶液中加入1mL0.1mol•L-1NaC1溶液,出现白色沉淀,再加入几滴0.1mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
5.在给定条件下,下列选项所示的物质间转化均能实现的是( )
| A. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| B. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Cu2(OH)2CO3$\stackrel{△}{→}$CuO$\stackrel{H_{2}O}{→}$Cu(OH)2 | |
| D. | SO2$\stackrel{氨水}{→}$NH4HSO3$\stackrel{H_{2}SO_{4}(aq)}{→}$(NH4)2SO4 |
2.药物阿司匹林可由水杨酸制得,它们的结构如图所示.有关说法正确的是( )


| A. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 1 mol阿司匹林最多可消耗2 mol NaOH |
3.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )


| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=1 | |
| C. | 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 | |
| D. | 200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5 |