题目内容
【题目】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是_________。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________(填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式_________。
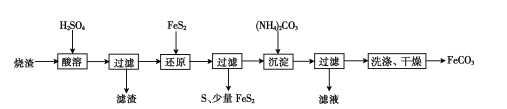
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。

①试剂 a 是_____。
②写出得到滤液 3 的离子方程式_______________。
③写出电解制镓时的阴极电极反应式__________________。
【答案】第三周期第 IIIA 族 c Ga 与As 电子层数相同,核电荷数:As > Ga,原子半径:As < Ga,得电子能力:As > Ga,元素的非金属性:As > Ga,因此,GaAs 中 As 为负价;As 与N 同主族,最外层 5 个电子,最低负化合价为-3 GaAs+HNO3(浓) =Ga(NO3)3+8NO2↑+H3AsO4+4H2O ZnO Ga(OH)3+OH- = [Ga(OH)4]- [Ga(OH)4]- +3e- = Ga+ 4OH-
【解析】
(1)铝是13号元素,铝在元素周期表中的位置是第三周期第 IIIA 族。故答案为:第三周期第 IIIA 族;
(2)①a. 同周期,从左到右元素的金属逐渐减弱,碱性:Ga (OH)3> Al (OH)3,故不选;
b. 同周期,从左到右元素非金属逐渐增强,非金属性:As>Ga,故不选;
c. 非羟基氧越多,含氧酸的酸性越强,酸性:H3AsO4>H3AsO3,故选;
故答案为:c;
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因:Ga 与As 电子层数相同,核电荷数:As > Ga,原子半径:As < Ga,得电子能力:As > Ga,元素的非金属性:As > Ga,因此,GaAs 中 As 为负价;As 与N 同主族,最外层 5 个电子,最低负化合价为-3。故答案为:Ga 与As 电子层数相同,核电荷数:As > Ga,原子半径:As < Ga,得电子能力:As > Ga,元素的非金属性:As > Ga,因此,GaAs 中 As 为负价;As 与N 同主族,最外层 5 个电子,最低负化合价为-3;
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,硝酸被还原成NO2,反应的化学方程式GaAs+HNO3(浓) = Ga(NO3)3+8NO2↑+H3AsO4+4H2O。故答案为:GaAs+HNO3(浓) = Ga(NO3)3+8NO2↑+H3AsO4+4H2O;
(3)闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)酸浸后得到:滤渣1中含PbSO4,滤液1中含有 Zn2+、Fe2+、Ga3+,加ZnO调节pH =9,得滤渣2,主要成分为Fe(OH)3、Ga(OH)3,加入浓NaOH溶液,发生Ga(OH)3+OH- = [Ga(OH)4]-,过滤得滤渣3为Fe(OH)3、滤液3,电解制镓。
①试剂 a 是ZnO。故答案为:ZnO;
②由题中信息:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在,得到滤液 3 的离子方程式Ga(OH)3+OH- = [Ga(OH)4]-。故答案为:Ga(OH)3+OH- = [Ga(OH)4]-;
③电解制镓时的阴极得电子,发生还原反应,电极反应式[Ga(OH)4]- +3e- = Ga+ 4OH-。故答案为:[Ga(OH)4]- +3e- = Ga+ 4OH-。

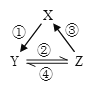
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____