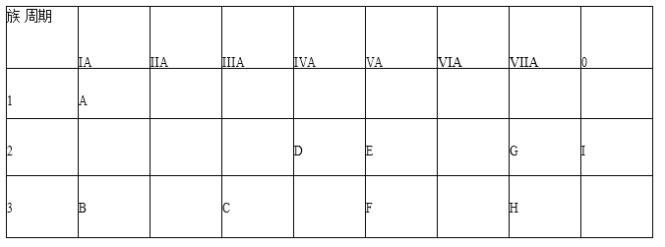
题目内容
【题目】 向400mL某浓度的稀硝酸中加入Wg铁粉(还原产物只有NO),充分反应后,铁粉减少16.8 g且铁粉有剩余,继续向容器中加入足量的稀硫酸,会产生气体A。回答下列问题:
(1)稀硝酸的物质的量浓度是_____________ mol·L1
(2)气体A中若含有H2,则W的值一定要大于__________g.
【答案】2 67.2
【解析】
过量铁与稀硝酸反应方程式是3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;继续向容器中加入足量的稀硫酸依次发生的反应是3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O、Fe+2H+= Fe2++H2↑。
(1)过量铁与稀硝酸反应方程式是3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;16.8 g铁粉的物质的量是![]() ,根据反应方程式,消耗硝酸的物质的量是0.8mol;铁粉有剩余,说明硝酸完全反应,所以硝酸的浓度是
,根据反应方程式,消耗硝酸的物质的量是0.8mol;铁粉有剩余,说明硝酸完全反应,所以硝酸的浓度是![]() 2 mol·L1;
2 mol·L1;
(2)加入硫酸前,溶液中的溶质是0.3mol Fe(NO3)2,则含有0.6mol NO3-;继续向容器中加入足量的稀硫酸,会产生气体A,气体A中若含有H2,依次发生的反应是3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O、Fe+2H+= Fe2++H2↑,根据0.6mol硝酸根离子,完成3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O反应,消耗铁粉的物质的量是0.9mol,所以 W的值一定要大于16.8g+0.9mol×56g/mol=67.2g。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进行了如下实验:取15 mL待测溶液于250 mL锥形瓶中,加入1~2滴酚酞试液,用NaOH标准溶液滴定。按上述操作方法再重复2次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则待测液的浓度________;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________;
③滴定时边滴边摇动锥形瓶,眼睛应观察________________________;
④滴定达到终点时,酚酞指示剂由________色变成________色。
(2)滴定结果如下表所示:
滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/ mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 1.05 | 21.10 | 15.00 |
2 | 2.00 | 21.95 | 15.00 |
若NaOH标准溶液的浓度为0.1010 mol/L,则待测液的浓度为________。
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。