题目内容
3.欲使Ag2CO3(Ksp=8.46×10-12)转化为Ag2C2O4(Ksp=5.4×10-12),必须使( )| A. | [C2O42-]>0.63[CO32-] | B. | [C2O42-]>1.6[CO32-] | ||
| C. | [C2O42-]<1.6[CO32-] | D. | [C2O42-]<0.63[CO32-] | ||
| E. | 无法判断 |
分析 Ag2CO3转化为Ag2C2O4,发生Ag2CO3(s)+C2O42-(aq)=Ag2C2O4(s)+CO32-(aq),K=$\frac{Ksp(A{g}_{2}C{O}_{3})}{Ksp(A{g}_{2}{C}_{2}{{\;}_{\;}O}_{4})}$=$\frac{8.64×1{0}^{-12}}{5.4×1{0}^{-12}}$=1.6,如生成沉淀,则应满足Qc>Ksp,以此解答该题.
解答 解:Ag2CO3转化为Ag2C2O4,发生Ag2CO3(s)+C2O42-(aq)=Ag2C2O4(s)+CO32-(aq),K=$\frac{Ksp(A{g}_{2}C{O}_{3})}{Ksp(A{g}_{2}{C}_{2}{{\;}_{\;}O}_{4})}$=$\frac{8.64×1{0}^{-12}}{5.4×1{0}^{-12}}$=1.6,如生成沉淀,则应满足Qc>Ksp,
即$\frac{[C{{O}_{3}}^{2-}]}{[{C}_{2}{{O}_{4}}^{2-}]}$>1.6,或[C2O42-]<0.63[CO32-],
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握计算公式的应用.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
14.向一定质量的稀盐酸中加入镁粉至过量,图中横坐标表示镁粉的质量,则纵坐标表示( ) 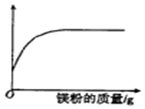

| A. | 溶液的质量 | B. | 稀盐酸的质量 | C. | 氯化镁的质量 | D. | 生成气体的质量 |
11.为证明醋酸是弱电解质,下列方法不正确的是( )
| A. | 测定0.1mol•L-1醋酸溶液的pH | |
| B. | 测定0.1 mol•L-1CH3COONa溶液的酸碱性 | |
| C. | 比较浓度均为0.1 mol•L-1盐酸和醋酸溶液的导电能力 | |
| D. | 比较相同物质的量浓度的NaOH溶液和醋酸溶液恰好反应完全时消耗两溶液的体积 |
18.化学“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动.下列利用家庭日常生活用品进行的实验都能达到如期目的一组是( )
①用碘酒来证明马铃薯中含有淀粉
②用食醋除去热水瓶中的水垢
③用肥皂水来检验自来水是否含有过多的Ca2+、Mg2+
④用聚光手电筒检验淀粉溶液具有丁达尔现象
⑤用肥皂水涂抹被蜂、蚁蜇咬后而引起的皮肤肿痛
⑥用食盐来吸收摔破的水银温度计中的水银.
①用碘酒来证明马铃薯中含有淀粉
②用食醋除去热水瓶中的水垢
③用肥皂水来检验自来水是否含有过多的Ca2+、Mg2+
④用聚光手电筒检验淀粉溶液具有丁达尔现象
⑤用肥皂水涂抹被蜂、蚁蜇咬后而引起的皮肤肿痛
⑥用食盐来吸收摔破的水银温度计中的水银.
| A. | ①②⑤⑥ | B. | ①②③④⑤ | C. | ②③④⑥ | D. | ①②③④⑥ |
8.2.0g NaOH固体溶于水配成100mL溶液,溶液中C(Na+)为( )
| A. | 0.2 mol/L | B. | 0.3mol/L | C. | 0.4 mol/L | D. | 0.5 mol/L |
15.下列离子方程式中正确的是( )
| A. | 工业上粗硅的制备:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | Cu2O与稀H2SO4反应:Cu2O+2H+═2Cu++H2O | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | 向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O+CO32- |
12.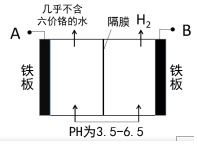 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )| A. | A接电源正极 | |
| B. | 阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O | |
| C. | 阴极区附近溶液pH减小 | |
| D. | 若不考虑气体的溶解,当收集到H2 13.44L时(标况),有0.1mol Cr2O72-被还原 |
13.下列物质中互为同分异构体的是( )
| A. | 麦芽糖和果糖 | B. | 蔗糖和麦芽糖 | C. | 淀粉和纤维素 | D. | 果糖和葡萄糖 |