题目内容
16.下列每组物质中含有的化学键类型相同的是( )| A. | NaCl HCl H2O NaOH | B. | Cl2Na2S HCl CO2 | ||
| C. | HBr CCl4H2O CO2 | D. | Na2O2H2O2H2O O2 |
分析 根据化合物的类型和离子化合物中一定含有离子键,可能含有共价键,共价化合物中一定不含离子键,含有共价键分析判断.
解答 解:A、NaCl中含有离子键、HCl含有共价键、H2O含有共价键、NaOH含有离子键和共价键,故A不符合;
B、Cl2含有共价键、Na2S含有离子键、HCl含有共价键、SO2含有共价键,故B不符合;
C、HBr、CO2、H2O、CS2分子中含的化学键都是共价键,故C符合;
D、Na2O2含有离子键和共价键、H2O2含有共价键、H2O含有共价键、O3含有共价键,故D不符合;
故选C.
点评 本题考查了根据化合物判断化学键类型,难度不大,明确离子键和共价键的区别是解答本题的关键.

练习册系列答案
相关题目
4. 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)在卡片上,记录合理的是⑤⑥(填序号).
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯(在锌片表面形成原电池).
(3)其他条件相同情况下,产生气泡的速率比单一锌片快(填“快”或“慢”),
如果将锌片换成铁片,电路中的电流方向不变(填“变”或“不变”).
(4)如果把硫酸换成硫酸铜溶液,猜测铜片(填“锌片”或“铜片”)变厚,原因是Cu2++2e-=Cu(用电极方程式表示).实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为0.2mol.
(5)有同学利用原电池原理,将A、B、C、D四种金属设计下表中装置进行实验用以判断四种金属的活泼性强弱.
根据以上现象,判断四种金属活泼性由强到弱的顺序是D>A>B>C.
 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:| 实验后的记录: ①Zn片发生还原反应,Cu片发生氧化反应 ②H+向负极移动 ③LED发光时,电子流动方向Zn→导线→Cu,再经溶液流回铜片 ④溶液的pH变小 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥装置中存在“化学能→电能→光能”的转换 |
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯(在锌片表面形成原电池).
(3)其他条件相同情况下,产生气泡的速率比单一锌片快(填“快”或“慢”),
如果将锌片换成铁片,电路中的电流方向不变(填“变”或“不变”).
(4)如果把硫酸换成硫酸铜溶液,猜测铜片(填“锌片”或“铜片”)变厚,原因是Cu2++2e-=Cu(用电极方程式表示).实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为0.2mol.
(5)有同学利用原电池原理,将A、B、C、D四种金属设计下表中装置进行实验用以判断四种金属的活泼性强弱.
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
8.下列有机物的命名正确的是( )
| A. | 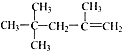 2,2,4-三甲基一4 一戊烯 2,2,4-三甲基一4 一戊烯 | |
| B. |  l,3,4一三甲苯 l,3,4一三甲苯 | |
| C. | CH3CH(CH3)CH(OH)CH3 2-甲基-3-丁醇 | |
| D. |  3,3,4-三甲基己烷 3,3,4-三甲基己烷 |
5.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染.下列做法不符合绿色化学理念的是( )
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 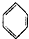 +CH2=CH2→ +CH2=CH2→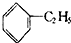 |
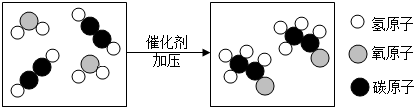
 )中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.
)中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.
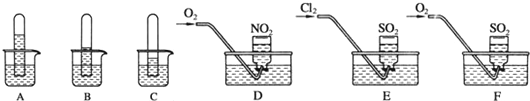
 .
. (填结构简式).
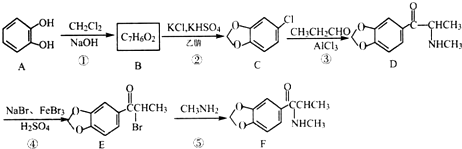
(填结构简式).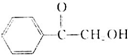 )的合成路线.
)的合成路线.